
【题目】铜、硫的单质及其化合物在生产、生活中应用广泛,辉铜矿(主要成分是Cu2S)是冶炼铜和制硫酸的重要原料.
(1)已知:①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1
则Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H= .
(2)已知25℃时,KSP(BaSO4)=1.1×1010 , 向仅含0.1molL﹣1 Ba(OH)2的废液中加入等体积0.12molL﹣1硫酸,充分搅拌后过滤,滤液中c(Ba2+)=
(3)上述冶炼过程中会产生大量的SO2 , 回收处理SO2 , 不仅能防止环境污染,而且能变害为宝,回收处理的方法之一是先将SO2转化为SO3 , 然后再转化为H2SO4 . ①450℃时,某恒容密闭容器中存在反应:2SO2(g)+O2(g)2SO3(g)△H<0,下列事实能表明该反应达到平衡的是 .
A.容器内气体密度不变
B.O2、SO2的消耗速率之比为1:2
C.n(SO2):n(O2):n(SO3)=2:1:2
D.容器内压强不再发生变化
②450℃、0.1MPa下,将2.0molSO2和1.0molO2置于5L密闭容器中开始反应,保持温度和容器体积不变,SO2的转化率(α)随着时间(t)的变化如图1所示,则该温度下反应的平衡常数K= . 若维持其他条件不变,使反应开始时的温度升高到500℃,请在图1中画出反应开始到平衡时SO2转化率的变化图象.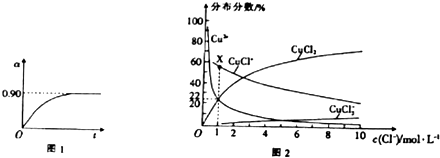
(4)已知CuCl2溶液中,铜元素的存在形式与c(Cl﹣)的相对大小有关,具体情况如图2所示(分布分数是指平衡体系中含铜微粒物质的量占铜元素总物质的量的百分比) ①若溶液中含铜微粒的总浓度为amolL﹣1 , 则X点对应的c(CuCl+)=(用含a的代数式表示).
②向c(Cl﹣)=1molL﹣1的氯化铜溶液中滴入少量AgNO3溶液,则浓度最大的含铜微粒发生反应的离子方程式为 .
【答案】
(1)﹣217.4kJ/mol
(2)1.1×10﹣8 mol/L
(3)D;4050
(4)0.56amol/L;CuCl++Ag+=AgCl↓+Cu2+
【解析】解:(1)①2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g)△H=﹣768.2kJmol﹣1 ②2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g)△H=+116.0kJmol﹣1 将方程式 ![]() 得Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H=
得Cu2S(s)+O2(g)=2Cu(s)+SO2(g)△H= ![]() kJ/mol=﹣217.4kJ/mol,
kJ/mol=﹣217.4kJ/mol,
所以答案是:﹣217.4kJ/mol;(2)KSP(BaSO4)=1.1×1010 , 假设两种溶液的体积都是1L,n[Ba(OH)2]=0.1mol/L×1L=0.1mol<n(H2SO4)=0.12mol/L×1L=0.12mol,所以硫酸剩余,溶液呈酸性,混合溶液中c(SO42﹣ )= ![]() =0.01mol/L,c(Ba2+)=
=0.01mol/L,c(Ba2+)= ![]() =
= ![]() mol/L=1.1×10﹣8 mol/L,
mol/L=1.1×10﹣8 mol/L,
所以答案是:1.1×10﹣8 mol/L;(3)①A.反应前后气体总质量不变、容器体积不变,所以容器内气体密度始终不变,不能据此判断平衡状态,故错误;
B.无论反应是否达到平衡状态都存在O2、SO2的消耗速率之比为1:2,不能据此判断平衡状态,故错误;
C.n(SO2):n(O2):n(SO3)=2:1:2 时该反应不一定达到平衡状态,与反应初始浓度及转化率有关,不能据此判断平衡状态,故错误;
D.反应前后气体物质的量减小、压强减小,当容器内压强不再发生变化时正逆反应速率相等反应达到平衡状态,故正确;
故选D;
②根据图知,二氧化硫的转化率为90%,开始时c(SO2)= ![]() =0.4mol/L、c(O2)=
=0.4mol/L、c(O2)= ![]() =0.2mol/L,参加反应的c(SO2)=0.4mol/L×90%=0.36mol/L,
=0.2mol/L,参加反应的c(SO2)=0.4mol/L×90%=0.36mol/L,
该反应
SO2(g) | O2(g)= | 2SO3(g) | |
开始(mol/L) | 0.4 | 0.2 | 0 |
反应(mol/L) | 0.36 | 0.18 | 0.36 |
平衡(mol/L) | 0.04 | 0.02 | 0.36 |
化学平衡常数K= ![]() =
= ![]() =4050;
=4050;
升高温度正逆反应速率都增大,反应到达平衡的时间缩短,升高温度平衡逆向移动,二氧化硫转化率降低,其图象为  ,
,
所以答案是:4050;  ;(4)①若溶液中含铜微粒的总浓度为amolL﹣1 , 则X点对应的c(CuCl+)=amol/L×(1﹣22%﹣22%)=0.56amo/L,
;(4)①若溶液中含铜微粒的总浓度为amolL﹣1 , 则X点对应的c(CuCl+)=amol/L×(1﹣22%﹣22%)=0.56amo/L,
所以答案是:0.56amol/L;
②根据图知,氯离子浓度减小,含铜微粒有CuCl+变为Cu 2+ , 反应离子方程式为CuCl++Ag+=AgCl↓+Cu2+
, 所以答案是:CuCl++Ag+=AgCl↓+Cu2+ .
【考点精析】解答此题的关键在于理解化学平衡状态的判断的相关知识,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等,以及对化学平衡的计算的理解,了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】碱性硼化钒﹣﹣空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5 , 室温下用该电池为电源,用惰性电极电解饱和氛化钠溶液,装置如图.当外电路中通过0.04mol电子时,乙装置中溶液的体积为400mL.则下列说法正确的是( ) 
A.外电路中电子由a电极流向b电极
B.电极上生成气体的体积为4.48L
C.乙装置中溶液的pH为13
D.VB2电极发生的电极反应为:VB2+11H2O﹣22e﹣=VB2+2B2O3+22H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是一座开放的“元素大厦”,“元素大厦”尚未“客满”。请你在“元素大厦”中为由俄罗斯科学家利用回旋加速器成功合成的119号超重元素安排好它的房间( )
A. 第八周期第ⅠA族
B. 第七周期第ⅦA族
C. 第七周期0族
D. 第六周期第ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于摩尔质量的叙述中正确的是( )
A. 1 mol CO的质量是28g·mol-1 B. 硫酸根离子的摩尔质量是98g
C. Cl2的摩尔质量是71 g·mol-1 D. NaCl的相对分子质量是58.5 g·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A(s)+B(g)C(g)+D(g)的化学平衡常数和温度的关系如表:
温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
化学平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
下列说法正确的是( )
A.该反应为吸热反应
B.该反应的化学平衡常数表达式为K= ![]()
C.其他条件不变时,增大体系的压强,化学平衡常数减小
D.单位时间内生成B和D的物质的量相等时,该反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法,正确的是( )
A. 苯在铁作催化剂时能使溴水褪色
B. 丙烷的一氯代物和七氯代物均只有两种
C. 乙醛可被还原为乙酸,被氧化成乙醇
D. CH3CH218OH和CH3COOH反应生成的水的相对分子质量为20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( ) 
A.t1s时反应物A的转化率为60%
B.在t1~(t1+10)s时,v(A)=v(B)=0
C.该反应的化学方程式为3A+B?2C
D.0~t1s内A的反应速率为v(A)= ![]() mol/(L?s)
mol/(L?s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com