
【题目】下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是( )
A.硫酸、Na2CO310H2O、Ca(OH)2
B.水、空气、纯碱
C.氧化铁、胆矾、生石灰
D.硝酸、食盐水、烧碱
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:__________________________________;
猜想2:__________________________________;
猜想3:__________________________________。
为了验证猜想,该小组设计实验加以探究。
(实验探究)
该小组同学按如图所示装置,将气体从a端通入。
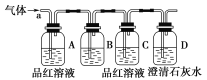
(1)B中应该放________试剂(填编号)。
a.NaCl溶液 B.酸性KMnO4溶液
c.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是_________________________________________。
(3)D中澄清石灰水的作用是_______________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色
②C中品红溶液不褪色
③D中澄清石灰水变浑浊
(得出结论)
(4)由上述现象该小组同学确认该气体为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系:
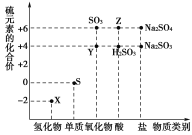
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有____________________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为________。
(3)检验物质Y的方法是_________________________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为______________________________________________________________。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体总体积的( )
A. 1/4 B. 3/4
C. 1/8 D. 3/8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等。
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为____。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10 10C+P4O10===P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有__。
(Ⅱ)(3)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象:_______,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为__________________.
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,符合下图所示关系的是( )
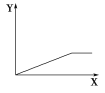
A. 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系
B. Fe在Cl2中燃烧,生成FeCl3的物质的量(Y)与消耗Cl2的物质的量(X)的关系
C. 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3的物质的量(Y)与消耗NaOH的物质的量(X)的关系
D. H2SO4溶液的物质的量浓度(Y)与溶液体积(X)的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g)![]() Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A. 以X浓度变化表示的反应速率为0.001mol·L-1·s-1
B. 将容器体积变为20L,Z的平衡浓度变为原来的![]()
C. 若增大压强,则物质Y的转化率减小
D. 若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。

(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家哈伯因为氨气的合成曾获1918年诺贝尔奖。
(1)写出实验室制取氨气的化学方程式_________。检验氨气已装满的方法是________。
(2)氨气可用如图装置进行喷泉实验,把氨气换成______(填序号)也可形成喷泉实验。
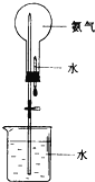
A.二氧化碳 B.氧气 C.氯化氢气体 D.氢气
(3)完成氨催化氧化生成为NO的反应方程式,4NH3+____O2===4NO+6_____,产物NO能在通常状况下被空气氧化为NO2,请完成下列反应生成硝酸的化学方程式:4NO+__O2+2H2O===4HNO3,___NO2+____O2 +__H2O===4HNO3
(4)12.8 g Cu与足量的浓硝酸反应生成的气体与一定量的O2混合,然后通入水中恰好完全反应无气体剩余,则该氧气的物质的量为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com