
【题目】下列反应中,浓硫酸既表现强酸性,又表现强氧化性的是
A.烧红的木炭和热的浓硫酸B.铜和浓硫酸共热
C.食盐和浓硫酸共热D.蔗糖中滴入浓硫酸
【答案】B
【解析】
在反应中浓硫酸体现酸性,说明和物质反应生成硫酸盐,又体现强氧化性,说明在反应中S元素得电子化合价降低,据此分析解答。
A.发生的反应为C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,该反应硫酸中S元素化合价由+6价变为+4价,所以浓硫酸作氧化剂,体现氧化性,A项错误;
CO2↑+2SO2↑+2H2O,该反应硫酸中S元素化合价由+6价变为+4价,所以浓硫酸作氧化剂,体现氧化性,A项错误;
B.发生的反应为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,该反应中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,所以浓硫酸体现酸性、强氧化性,B项正确;
CuSO4+SO2↑+2H2O,该反应中部分S元素化合价不变、部分S元素化合价由+6价变为+4价,所以浓硫酸体现酸性、强氧化性,B项正确;
C.发生的反应为 2NaCl+ H2SO4(浓)![]() 2HCl↑+Na2SO4,该反应中各元素化合价不变,属于复分解反应,浓硫酸体现酸性,C项错误;
2HCl↑+Na2SO4,该反应中各元素化合价不变,属于复分解反应,浓硫酸体现酸性,C项错误;
D.浓硫酸将有机物中的H、O元素以2:1水的形式脱去而体现脱水性,还能将C氧化为二氧化碳而强氧化性,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法、②水煤气(或氢气,或一氧化碳)法、③活泼金属置换法、④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜、(Ⅱ)湿法炼铜、(Ⅲ)铝热法炼铬、(Ⅳ)从光卤石中炼镁,对它们的冶炼方法分析不正确的是( )
A.Ⅰ用①B.Ⅱ用②C.Ⅲ用③D.Ⅳ用④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,对碳、氮及化合物的研究备受关注。已知:
I.2C(s)+2NO(g)![]() N2(g)+2CO(g)
N2(g)+2CO(g) ![]() =-414.8kJ/mol
=-414.8kJ/mol
II.2CO(g)+O2(g)![]() 2CO2 (g)
2CO2 (g)![]() =-566kJ/mol
=-566kJ/mol
III.2CO(g)+2NO(g)![]() N2(g)+2CO2 (g)
N2(g)+2CO2 (g)![]() =-759.8kJ/mol
=-759.8kJ/mol
回答下列问题:
(l) N2的电子式为 ___ 。
(2)表示碳的燃烧热的热化学方程式为____。
(3)某催化剂的M型、N型均可催化反应2CO(g)+O2 (g)=2CO2 (g)。向容积相同的恒容密闭容器中分别充入等量的CO和O2,在相同时间段内,不同温度下测得CO的转化率(a)如图所示。

①由图推断下列说法正确的是 ___(填选项字母)。
A.a、b、c、d点均达到平衡状态B.该反应的平衡常数K(b)=K(c)
C.b点反应物的有效碰撞几率最大D.图中五个点对应状态下,a点反应速率最慢
②e点CO的转化率突然减小的可能原因为_______________________
③若b点容器中c(O2)=0.5 mol·L-l,则To℃时该反应的平衡常数K=________
(4) T1℃时,向刚性容器中充入2 mol NO和2 mol CO,发生反应Ⅲ。5 min时达到平衡状态,测得容器中n(N2) =0.8 mol、c(CO2)=0. 32 mol/L。
①0~5 min内,用NO表示的反应速率v(NO)=_________
②反应进行到2 min时,v正(CO) ___v逆(CO2)(填“>”“<”或“=”)。
③若升高温度,容器内气体压强____(填“增大”“减小”或“不变”),原因为 ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需精确配制480mL0.100mol/L的CuSO4溶液,以下操作正确的是
A.称取7.68gCuSO4,配成500mL溶液
B.称取12.0g胆矾,配成500mL溶液
C.称取8.0gCuSO4,加入500mL水
D.称取12.5g胆矾,配成500mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH 溶液将NiCl2溶液的pH调至7.5(该pH下溶液中的Ni2+不沉淀),加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2(不考虑Cl2的逸出)在弱碱性条件下生成ClO﹣,ClO﹣再把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3,电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阴、阳两极附近溶液的pH均升高
C. 当有1mol Ni2+氧化为Ni3+时,外电路中通过的电子数目为1NA,通过阳离子交换膜的Na+数目为1NA
D. 反应前后b池中Cl- 浓度几乎不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂),我国卫生部规定实验中黄血盐的最大使用量为10mg/kg。一种制备黄雪盐的工艺如下:

回答下列问题:
(1)步骤Ⅰ反应的化学方程式为__________________________。
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为____________(填化学式)。
(3)步骤Ⅴ所用的试剂X是___________。(填化学式)
(4)工艺中用到剧毒的HCN溶液,含CN- 的废水必须处理后才能排放。
已知: HCN是一种具有苦杏仁味的无色剧毒液体,易挥发,25℃时Ka(HCN)=6.25×10-10;溶液中H2CO3、HCO3-、CO32-的存在与溶液pH的关系如图所示:
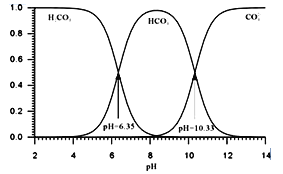
①NaCN的电子式为___________。
②处理含CN-废水的方法:第一步控制pH>10,用NaClO溶液先将CN-不完全氧化为OCN-;第二步控制pH为7.5~8.5,用NaClO溶液完全氧化OCN-生成N2和两种盐。第一步控制强碱性的主要目的是_______,第二步反应的离子方程式为____________。
(5)已知蓝色染料普鲁士蓝的合成方法如下:

用硫酸亚铁碱性试纸可以检验食品中是否含有CN-,方案如下:

若试纸变蓝则证明食品中含有CN-,基于普鲁士蓝的合成原理,请解释检测时试纸变蓝的原因:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实或操作不符合平衡移动原理的是( )
A. 开启啤酒有泡沫逸出
B. H2、I2、HI平衡混合气加压后颜色变深
C. 装有NO2的烧瓶置于热水中颜色加深
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.酯的水解反应和酯化反应都属于取代反应
B.乙烯能使溴水褪色,发生氧化反应
C.乙醇不能被酸性高锰酸钾溶液氧化
D.葡萄糖不能发生银镜反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com