
【题目】类比法是一种重要的化学思维方法。下列各项中的已知和类比结论均正确的是
选项 | 已知 | 类比结论 |
A | 汞可以用热分解法冶炼 | 铜也可以用热分解法冶炼 |
B | Mg-Al插入稀H2SO4溶液中构成 原电池,Mg作负极 | Mg-Al插入稀NaOH溶液中构成原电池,Mg也作负极 |
C | 硫元素的最高正化合价为+6 | 氧元素的最高正化合价也为+6 |
D | Si是半导体材料 | Ge也可作半导体材料 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】下列两种气体的分子数一定相等的是( )
A.体积相等、质量不等的CO和N2
B.等温等体积的O2和N2
C.等体积等密度的CO和N2
D.等压等体积的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏伽德罗常数的值。下列叙述正确的是( )
A.1.0L 1.0mol·L-1 的 NaAlO2 水溶液中含有的氧原子数为 2NA
B.28g 聚乙烯中含有碳碳双键的个数为 1NA
C.标况下,含 0.5 NA 个氖原子的氖气占有的体积约为 11.2L
D.1 mol 的羟基与 1 mol 的氢氧根离子所含电子数均为 9NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相应有机物的描述完全正确的是( )
①甲烷:与氯气在光照条件下反应生成的CH2Cl2有两种结构
②乙烯:可发生加成反应和加聚反应,其产量可以用来衡量一个国家石油化工发展水平
③苯:12个原子共平面,1mol苯中含有3mol碳碳双键
④乙醇:常温下具有特殊香味的液体,常用作调味品,也可以用来杀菌消毒
⑤油脂:属于酯类,在碱性条件下发生水解反应生成甘油和高级脂肪酸,称为皂化反应
⑥蔗糖:糖尿病人尿液的成分之一,可以用新制Cu(OH)2检验
⑦蛋白质:水解的最终产物为氨基酸,部分蛋白质遇浓硝酸显黄色
A.②④⑤⑦B.②④⑦C.①②③⑤⑥⑦D.②④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝-空气-海水为能源的电池为我国首创,该电池用于航海标志灯,只要把灯放入海水中数秒钟,就会发出耀眼的白光。电极材料为Al与石墨。该电池工作时,下列说法正确的是
A.铝电极是该电池的正极B.海水中Cl-向石墨电极移动
C.石墨电极的反应:O2+2H2O+4e-=4OH-D.该新型电池属于二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②![]() 、
、![]() 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1)HmDm的电子式___________________。
(2)![]() 、
、![]() 的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
的还原性强弱顺序为:_________,(用离子符号表示)能证明其还原性强弱的离子方程式为________________________________。
(3)写出B单质与A元素的最高价氧化物对应水化物的溶液反应的离子方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是我们熟悉的物质:
①O2 ②SO2 ③CaCl2 ④HNO3 ⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

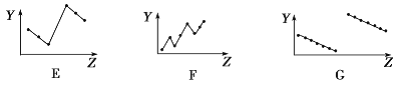
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式 (写一种); D的化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的化工原料,用途广泛。
(1)合成氨工厂常用醋酸二氨合铜(由[Cu(NH3)2]+和CH3COO-构成)溶液吸收对氨合成催化剂(铁粉)有毒害的CO气体。
①醋酸二氨合铜所含的元素中,第一电离能最大的是 。(填元素符号)
②醋酸二氨合铜所含元素的单质,所属的晶体类型有 (填序号)。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
③第4周期中,基态原子与基态Cu原子未成对电子数目相同的元素有 种(不包括Cu)。
④铜单质为面心立方晶体,其晶胞如图。如果Cu的原子半径为a cm,阿伏加德常数的值为NA,则此种Cu单质的密度表达式为 g/cm3。(相对原子质量Cu:64)


(2)BF3气体与NH3相遇立即生成一种白色晶体:BF3+ NH3=F3B—NH3。写出两种与BF3具有相同空间构型的阴离子 、 。
(3)NH3可用于合成尿素、硫酸铵等氮肥。某化肥厂从生产的硫酸铵中检出一种组成为N4H4(SO4)2的物质。该物质在水溶液中以SO42-和N4H44+两种正四面体构型的离子存在。N4H44+遇碱生成一种形似白磷的N4分子。画出N4H44+的结构(标明其中的配位键) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷的用途很广泛。
(1)已知:
2NO2(g )![]() N2O4(g) △H= -56.9kJ·mol -1
N2O4(g) △H= -56.9kJ·mol -1
H2 O(g)= H2O(l) △H= -44.0kJ·mol -1
CH4(g)+N2O4 (g)= N2(g)+2H2O(l)+CO2 (g) △H=-898.1kJ·mol -1
则 CH4 (g)催化还原NO2 (g)生成 N2(g)和H2O(g)的热化学方程式为_____________________。
(2)一定条件下,发生2NO(g)+2CO(g)![]() N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:
N2(g) +2CO2(g) △H<0。在不同时间c(NO)与c(CO)如下表所示:

①该温度下,该反应的平衡常数表达式为K =_____________________;
②计算前4秒内氮气的平均反应速率为____________________;
③下列选项中,不能说明上述反应已达平衡的是( )
A.2v正(NO)= v逆(N2 )
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中CO的质量不再发生变化
E. 容器中气体的总压强不随时间而变化
(3)CH4燃料电池原理如图所示

①该燃料电池的正极为_______________(填“a”或“b”)。该电池负极的电极反应式为_____________;
②放电一段时间后,电解质溶液的pH___________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com