
【题目】(1)下面是我们熟悉的物质:
①O2 ②SO2 ③CaCl2 ④HNO3 ⑤NaOH ⑥NH4Cl
这些物质中,属于共价化合物的是 ___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。

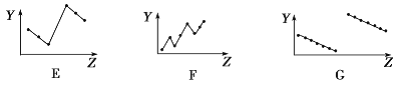
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径________________。
③第二、三周期主族元素随原子序数递增原子半径的变化____________。
(3)已知某单核粒子的结构示意图为:![]()
①当x-y=10时,该粒子为____________(填“原子”、“阳离子”或“阴离子”)。
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,该微粒的符号是_____。
(4)已知A、B、C、D是中学化学中常见的四种10电子微粒,它们之间存在如图中转化关系。

请写出:A的化学式 (写一种); D的化学式 。
【答案】(1) ②④ ;③⑤⑥ ;③(2) ①B ②E ③G (3)①原子 ②K+ (4)HF(或NH4+);H2O
【解析】
试题分析:(1)只含共价键的化合物属于共价化合物,是②④;含有离子键的化合物属于离子化合物,是③⑤⑥;只含离子键的是③;
(2)①第ⅡA族元素的最外层电子数都是2,对应图像B;
②第三周期离子Na+、Mg2+、Al3+、P3-、S2-、Cl-的离子半径大小为P3->S2->Cl->Na+>Mg2+>Al3+,对应图像E;
③同一周期从左到右,半径逐渐减小,则第二、三周期主族元素随原子序数递增,原子半径的变化对应图像G;
(3)①当x-y=10时,核内质子数等于核外电子数,则该粒子为原子;
②当y=8时,若该微粒的氧化性很弱,得一个电子后变为原子,说明为19号元素,则该微粒的符号是K+;
(4)A、B、C、D是10电子微粒,发生反应A+B=C+D,则A、B可为OH-、NH4+,C、D为NH3、H2O。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列各选项中错误的是( )
A.离子半径:Li+<Na+<K+
B.稳定性:SiH4>H2S>HF
C.酸性:H2SiO3<H2CO3<HNO3<HClO4
D.碱性:Be(OH)2<Mg(OH)2<NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R同周期,R与Y同主族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.简单氢化物的熔沸点:Y<RB.简单离子半径:R>Y>Z>W
C.X2Y2和Z2Y2均为含有非极性键的离子化合物D.常温下,W的单质与R的最高价含氧酸的浓溶液不发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比法是一种重要的化学思维方法。下列各项中的已知和类比结论均正确的是
选项 | 已知 | 类比结论 |
A | 汞可以用热分解法冶炼 | 铜也可以用热分解法冶炼 |
B | Mg-Al插入稀H2SO4溶液中构成 原电池,Mg作负极 | Mg-Al插入稀NaOH溶液中构成原电池,Mg也作负极 |
C | 硫元素的最高正化合价为+6 | 氧元素的最高正化合价也为+6 |
D | Si是半导体材料 | Ge也可作半导体材料 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为___________________________________;
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为___________;

(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有___________(举2例).
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO![]() OHC-CH2CH2OH;
OHC-CH2CH2OH;
OHC-CH2CH2OH中碳原子杂化方式有___________,乙炔属于___________(填“极性”或“非极性”)分子.
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称溶质的化学式为___________,其中含有的化学键类型有______________________;
(6)已知铜镁互化物晶胞参数为apm,则该晶胞的密度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达菲”是瑞士罗氏公司研制的有效治疗人类禽流感的药物。达菲的主要合成原料是我国盛产的莽草酸。


下列说法不正确的是( )
A.莽草酸可溶于水
B.1 mol莽草酸最多可和4 molNaOH溶液反应
C.从结构上推测,达菲既可与盐酸反应又可与氢氧化钠溶液反应
D.从结构上推测,以莽草酸为原料合成达菲须经过酯化反应等步骤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O),过程如下:

(1)验证固体W焙烧后产生的气体含有SO2的方法是:
___________________________________________________________________。
(2)实验室制备、收集干燥的SO2,所需仪器如下。装置A产生SO2,按气流方向连接各仪器接口,顺序为a→____→____→____→____→f。
装置A中发生反应的化学方程式为_________________________________________。
装置D的作用是_____________,装置E中NaOH溶液的作用是__________________。

(3)制备绿矾时,向溶液X中加入过量__________,充分反应后,经过滤操作得到溶液Y,再经浓缩、结晶等步骤得到绿矾。过滤所需的玻璃仪器有_______________________。
(4)欲测定溶液Y中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液,定容时视线应_____________________,直到_____________________。用KMnO4标准溶液滴定时应选用________滴定管(填“酸式”或“碱式”)。
(5)溶液Z的pH影响聚铁中铁的质量分数。若溶液Z的pH偏小,将导致聚铁中铁的质量分数______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:2X(g)+Y(g) == nZ(g)+2W(g) 1 min末已生成0.2 mol W ,若测知以Z的浓度变化表示的反应速率为0.005 mol·L-1·s-1 ,计算:
(1)前1 min内用X的浓度变化表示的平均反应速率。
(2)1 min末时Y的浓度。
(3)化学反应方程式中n的值是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学所做的有关铜元素的实验流程如图:

(1)写出基态铜原子的价电子排布式________________________,向深蓝色溶液中加入适量乙醇,会析出深蓝色晶体,该晶体中存在的化学键的类型有________________________。
(2)写出反应④的离子方程式________________________。
(3)铜能与类卤素(SCN) 2反应生成Cu(SCN) 2,1 mol (SCN)2分子中含有的δ键数目为类卤素(SCN)2对应的酸有两种,理论推测硫氰酸(H-S-C![]() N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
N)的沸点低于异硫氰酸(H-N=C=S)的沸点,其原因是__________________;写出一种与SCN-互为等电子体的分子_________________(用化学式表示)。
(4)氨基乙酸铜的分子结构如图,碳原子的杂化方式为____________________。

(5)铜晶胞中,其晶体的堆积方式为_______________,一个晶胞中铜原子的数目为__________,空间利用率为____________(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com