
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:

 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
| ||
| A、木炭与氧化铜在高温下反应生成铜和二氧化碳 |
| B、12份质量的碳可与160份质量的氧化铜在高温下反应生成128份质量的铜和44份质量的二氧化碳 |
| C、若以NA代表6.02×1023个粒子,则NA个碳原子与2NA个氧化铜分子在高温下反应,生成2NA个铜原子和NA个二氧化碳分子 |
| D、一个碳原子和两个氧化铜分子高温加热时可生成两个铜原子和一个二氧化碳分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
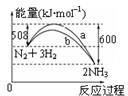 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 普通水泥在固化过程中自由水分子减少并产生Ca(OH)2使溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O═2CuO+2Ag,下列有关说法正确的是( )
普通水泥在固化过程中自由水分子减少并产生Ca(OH)2使溶液呈碱性.根据这一物理化学特点,科学家发明了电动势法测水泥初凝时间.此方法的原理如图所示,反应的总方程式为:2Cu+Ag2O═2CuO+2Ag,下列有关说法正确的是( )| A、电池工作时,OH-向正极移动 |
| B、测量原理示意图中,Ag2O为负极 |
| C、电流方向是从Ag2O/Ag电极到Cu电极 |
| D、正极的电极反应为:2Cu+2OH--2e-═Cu2O+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期的实验现象及结论 |
| 取适量的白色固体于试管中,… |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com