
| 实验步骤 | 预期的实验现象及结论 |
| 取适量的白色固体于试管中,… |
| 取适量的白色固体置于试管中,加蒸馏水溶解,再滴加稀硫酸酸化,最后应滴加高锰酸钾溶液. | 若高锰酸钾溶液不褪色,则假设2成立;若高锰酸钾溶液褪色,则假设2不成立. |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 根据下列叙述写出相应的热化学方程式:
根据下列叙述写出相应的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2O、MgO、CaO |
| B、MgO、K2O、CaO |
| C、MgO、CaO、K2O |
| D、CaO、MgO、K2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则查看答案和解析>>
科目:高中化学 来源: 题型:
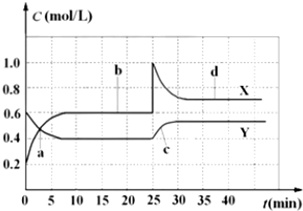
查看答案和解析>>
科目:高中化学 来源: 题型:
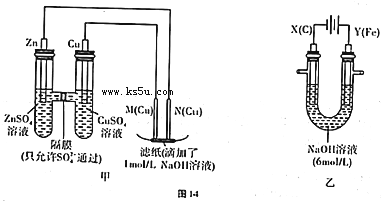
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲溶液含有Ba2+ |
| B、乙溶液含有SO42- |
| C、丙溶液含有NH4+ |
| D、丁溶液含有HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com