
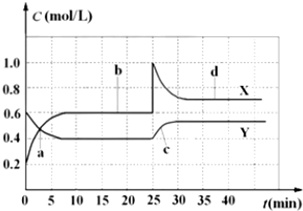
| 0.4 |
| 0.62 |
| 10 |
| 9 |
| 0.6-0.2 |
| 10 |
| 1-0.7 |
| 35-30 |
| 10 |
| 9 |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) |
| B、pH=11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| C、0.1 mol?L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol?L-1 |
| D、0.1 mol?L-1的醋酸钠溶液20 mL与0.1 mol?L-1盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期的实验现象及结论 |
| 取适量的白色固体于试管中,… |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯滴入溴水中振荡后水层接近无色,发生了化学反应 |
| B、乙烯和乙烷都可以与氢气发生加成反应 |
| C、烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于料酒中的乙醇和食醋中的乙酸反应生成的乙酸乙酯 |
| D、乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、双氧水被称为绿色氧化剂,是因为其还原产物为O2,对环境没有污染 |
| B、新制备的氯水中只存在三种分子、三种离子 |
| C、10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、浓硝酸与浓盐酸一样,在空气中出现白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
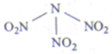 科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )
科学家最近研制出可望成为高效火箭液态推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,用NA表示阿伏加德罗常数,下列有关N(NO2)3的说法正确的是]( )| A、分子中四个氮原子共平面 |
| B、7.6 g N(NO2)3和N2O3混合物中共含氮原子数为0.2NA |
| C、标准状况下,2.24L N(NO2)3含有的分子数为0.1NA |
| D、15.2g该物质含有0.6NA个非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子中中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构 |
| B、杂化轨道只用于形成σ键或用于容纳未参与成键的孤对电子 |
| C、杂化轨道理论与价层电子互斥理论都可以分析分子的空间构型 |
| D、[Cu(NH3)4]2+和CH4两个微粒中中心原子Cu和C都是通过sp3杂化轨道成键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com