
| A、苯滴入溴水中振荡后水层接近无色,发生了化学反应 |
| B、乙烯和乙烷都可以与氢气发生加成反应 |
| C、烹鱼时加入少量食醋和料酒可以使烹制的鱼具有特殊的香味,这种香味来自于料酒中的乙醇和食醋中的乙酸反应生成的乙酸乙酯 |
| D、乙酸的酸性比碳酸强,所以它可以跟碳酸盐溶液反应,产生CO2气体 |


科目:高中化学 来源: 题型:
| 5 |
| 4 |
| 1 |
| 4 |
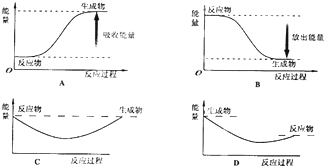
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
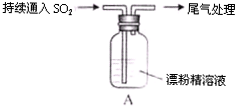 | i液面上方出现白雾; ii稍后,出现浑浊,溶液变为黄绿色; iii稍后,产生大量白色沉淀,黄绿色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
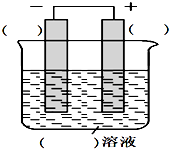 下列是构成原电池的实验方案,请按要求回答下列问题:
下列是构成原电池的实验方案,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
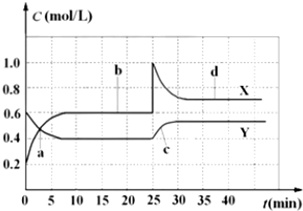
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、部分为 Al(OH)3沉淀,部分以Al3+形式存在 |
| B、全部以[Al(OH)4]-(AlO2-)的形式存在 |
| C、全部为Al(OH)3沉淀 |
| D、部分为Al(OH)3,部分为[Al(OH)4]- (AlO2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升温增压 | B、降温减压 |
| C、升温减压 | D、降温增压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com