
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. ![]()
B. ![]()
C. ![]()
D. ![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】三氧化二镍(Ni2O3)可用于制造高能电池元件。电解法制备过程如下:用NaOH溶液将NiCl2溶液的pH调至7.5,加入适量硫酸钠固体后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍(可简单写成Ni2+)氧化为Ni3+,再将Ni3+经一系列反应后转化为Ni2O3.电解装置如图所示。下列说法不正确的是( )

A. 加入适量硫酸钠的作用是增加离子浓度,增强溶液的导电能力
B. 电解过程中阳极附近溶液的pH降低
C. 电解过程中,溶液中的Cl-经阳离子交换膜向阳极移动
D. ClO-氧化Ni2+的离子方程式为:ClO-+H2O+2Ni2+=Cl-+2Ni3++2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烧碱样品含有少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A. 在250 mL的容量瓶中定容配制250 mL烧碱溶液;
B. 用碱式滴定管移取25.00 mL烧碱溶液于锥形瓶中并滴入2滴甲基橙指示剂;
C. 在天平上准确称取烧碱样品2.0 g,在烧杯中用蒸馏水溶解;
D. 将物质的量浓度为0.100 0 mol·L-1的标准盐酸装入酸式滴定管,调整液面记下开始读数为V1;
E. 在锥形瓶下垫一张白纸,滴定至终点,记下读数V2。
就此实验完成下列填空:
(1)正确的操作步骤的顺序是(用编号字母填写)
________→________→________→D→________。
(2)上述E中锥形瓶下垫一张白纸的作用是_______________________________
(3)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视______________。直到加入一滴盐酸后,溶液____________________________ (填颜色变化)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是(____________)
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用盐酸溶液的体积为________mL。

(6)某学生根据3次实验分别记录有关数据如表:
滴定 次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前 刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该烧碱的纯度____。(结果保留四位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期主族元素,且原子序数依次递增。A的原子核内无中子,B的原子最外层电子数是次外层电于数的2倍,C是地壳中含量最多的元素,D是短周期中金属性最强的元素,E与F位置相邻,F是同周期元素中原子半径最小的元素。
完成下列填空题:
(1)B在元素期表中的位置为_______,1个C原子核外有____个未成对的电子。
(2)D、E、F三种元素形成简单离子其半径由l大到小的顺序是_____________。(用离子符号表示)。
(3)写出D与C形成化合物的电子式______、_______。
(4)常温下,1molA的单质在C的单质中完全燃烧生成液态化合物,并放出286kJ的热量,该反应的热化学方程式为______________。
(5)非金属性的强弱:E_____F(填“强于”、“弱于”、“无法比较”),试从原子结构的角度解释其原因________________。
(6)Na2SO3可用作漂白织物时的去鼠剂。Na2SO3溶液及收Cl2后,溶液的酸性增强。写出该反应的离子方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲探究氯气的化学性质,设计如图所示的实验装置。

已知:该装置气密性良好;铜粉放在耐高温托盘内(防止硬质玻璃管炸裂)。
请回答下列问题:
(1)为防止铜与空气中的氧气反应,在加热之前应该进行的操作为____。
(2)当观察到AgNO3溶液中出现白色沉淀时,点燃酒精灯加热;写出AgNO3溶液中生成白色沉淀的化学方程式:____。
(3)硬质玻璃管中的反应现象为__,反应的化学方程式为___。
(4)装置中空试管的作用是____。
(5)烧杯中氢氧化钠溶液的作用是___,发生反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出木炭与浓硫酸反应的化学方程式____。
为了验证产物中的二氧化碳气体,甲、乙两同学分别设计如下实验(已知Br2+2H2O+SO2=H2SO4+2HBr):
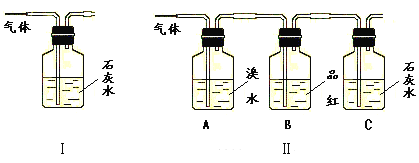
请回答下列问题:
(1)能否根据Ⅰ装置中石灰水变浑浊的现象说明产物中一定有二氧化碳气体?___,理由是____。
(2)Ⅱ装置中A的作用是___;B的作用是___。
(3)根据B中品红__,C中产生___,说明产物中一定有二氧化碳气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。
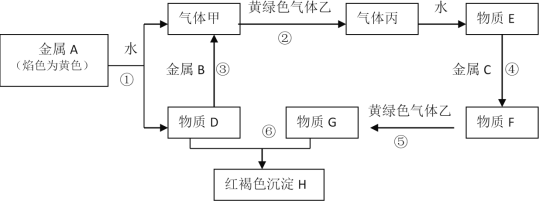
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A___、 B___、C___、F___、H___、乙___。
(2)写出下列反应化学方程式:
反应⑤____。
反应⑥____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近有科学家研发了一种新型锂空气电池,结构如下图所示。已知:①电解质由离子液体(离子能够自由移动,非溶液)和二甲基亚砜[(CH3)2SO]混合制成,可促进过氧化锂生成;②碳酸锂薄层的作用是让锂离子进入电解质,并阻止其它化合物进入该电极;③二硫化钼起催化作用。该装置工作时,下列叙述不正确的是

A. 放电时,a极发生氧化反应
B. 放电时的总反应为:2Li+O2=Li2O2
C. 充电时,Li+在电解质中由b极移向a极
D. 充电时,b极的反应式:Li2O2+2e-=2Li+O22-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com