
����Ŀ������������(Ni2O3)������������ܵ��Ԫ������ⷨ�Ʊ��������£���NaOH��Һ��NiCl2��Һ��pH����7.5���������������ƹ�������е�⡣�������в�����Cl2������������������ClO-���Ѷ�����(�ɼ�д��Ni2+)����ΪNi3+���ٽ�Ni3+��һϵ�з�Ӧ��ת��ΪNi2O3�����װ����ͼ��ʾ������˵������ȷ����(����)

A. �������������Ƶ���������������Ũ�ȣ���ǿ��Һ�ĵ�������
B. ������������������Һ��pH����
C. �������У���Һ�е�Cl-�������ӽ���Ĥ�������ƶ�
D. ClO-����Ni2+�����ӷ���ʽΪ��ClO-+H2O+2Ni2+=Cl-+2Ni3++2OH-
���𰸡�C
��������
A.��������һ��ǿ����ʣ������м��������ƣ���Ϊ����������Ũ�ȣ���ǿ��Һ�ĵ���������A��ȷ��
B.�������У�������Ӧ��2H++2e-=H2�����ٽ�ˮ�ĵ��룬����������Ũ�����ü�������Һ��pH���ߣ�������Ӧ��2Cl--2e-=Cl2�����������������������ɵ�������ˮ��Ӧ��������ʹ����ᣬʹ��Һ��pH���ͣ�B��ȷ��
C.�����ӽ���Ĥֻ��������������ͨ�����������У���Һ�е�Cl-����ͨ�������ӽ���Ĥ��C����
D.ClO-��Ni2+����ΪNi3+��ClO-����ԭ����Cl-�����ݵ����غ㡢ԭ���غ㼰�绰�غ㣬�ɵø÷�Ӧ�����ӷ�ӦΪ��ClO-+H2O+2Ni2+=Cl-+2Ni3++2OH-��D��ȷ��
�ʺ���ѡ����C



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͼ�ǽ���þ��±�ص���(X2)��Ӧ�������仯ʾ��ͼ��
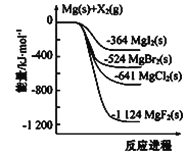
д��MgBr2(s)��Cl2(g)����MgCl��s����Br2��l�����Ȼ�ѧ����ʽ______________________________��
��2���״�ȼ�ϵ�أ��ṹ��ͼ�������ӽ���Ĥ�����������Һ��Ϊ1L2mol��L-1H2SO4��Һ�����������2mol e-����ת��ʱ������������Һ������֮��Ϊ______g�����跴Ӧ��ľ�������������ܽ⣩��

��3��250mLK2SO4��CuSO4�Ļ����Һ��c(SO42-)��0. 5mol��L��1����ʯī���缫������Һ����ͨ��һ��ʱ����������ռ���1.12L���壨��״���£����ٶ�������Һ�����Ϊ250mL��д�������缫��Ӧʽ______________ԭ�����Һ��c(K��)��__________________
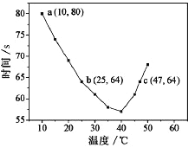
��4��NaHSO3��Һ�ڲ�ͬ�¶��¾��ɱ�����![]() KIO3��������Ũ�Ⱦ�Ϊ0.020mol/L
KIO3��������Ũ�Ⱦ�Ϊ0.020mol/L![]() NaHSO3��Һ�����������ۣ�10ml
NaHSO3��Һ�����������ۣ�10ml![]() ��KIO3(����)������Һ90.0ml��ϣ���¼10��55�����Һ����ʱ�䣬ʵ������ͼ����ͼ������ͼ��a���Ӧ��
��KIO3(����)������Һ90.0ml��ϣ���¼10��55�����Һ����ʱ�䣬ʵ������ͼ����ͼ������ͼ��a���Ӧ��![]() NaHSO3��Ӧ����Ϊ________________
NaHSO3��Ӧ����Ϊ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ֲ���纣���������к��зḻ�ĵ�Ԫ�أ���Ԫ���Ե����ӵ���ʽ���ڣ�ʵ������Ӻ�������ȡ��Ĺ������£�
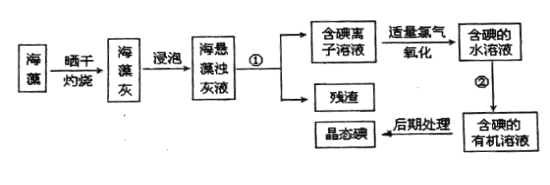
����д���пհף�
��1�����պ���ʱ������Ҫ���ż�.�������⣬����Ҫ�õ���ʵ��������________________����������������ѡ��������������ñ����ĸ��д�ڿհ״�����
A.�ձ� B.������ C.������ D.������ E.�ƾ��� F.����ǯ
��2��ָ����ȡ��Ĺ������йص�ʵ��������ƣ���________����________
��3����ȡ��Ĺ��̢��У�ͨ����________________���������ƣ��н��У����õ����Ǻ�������Ȼ�̼��Һ�����ú�ֲ㣬�²�Ϊ________________ɫ��
��4�����������������ӷ���ʽ��ʾ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��������ɺϳ���ϩ��2CO2 (g) ��6H2 (g) ![]() C2H4(g)��4H2O(g)��0.2 MPaʱ����n(CO2)��n(H2)=l��3Ͷ�ϣ���ò�ͬ�¶���ƽ��ʱ��ϵ�и�����Ũ�ȵĹ�ϵ��ͼ������������ȷ����
C2H4(g)��4H2O(g)��0.2 MPaʱ����n(CO2)��n(H2)=l��3Ͷ�ϣ���ò�ͬ�¶���ƽ��ʱ��ϵ�и�����Ũ�ȵĹ�ϵ��ͼ������������ȷ����

A. �÷�ӦΪ���ȷ�Ӧ
B. ����a��������C2H4
C. N���M������״̬��c(H2O)���
D. �����������䣬T1�桢0.1 MPa�·�Ӧ��ƽ��ʱCO2��ת���ʱ�N�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϡ�����ϡ����Ļ����Һ200mL��ƽ���ֳ����ݡ�������һ��������ͭ�ۣ�������ܽ�l9.2g(��֪����ֻ����ԭΪNO���壬��ͬ)������һ�����������ۣ�������������������������ӵı仯��ͼ��ʾ������˵����ȷ����(����)

A. c��ʱ����Һ�е�����ΪFe2(SO4)3
B. ab�η�����Ӧ�����ӷ���ʽΪ��Fe+Fe3+=2Fe2+
C. ԭ�������ϡ��������ʵ���Ũ��Ϊ0.4mol/L
D. ԭ�������ϡ��������ʵ���Ũ��Ϊ4mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������������ǿ����ʵ���______������������ʵ���______�����ڷǵ���ʵ���_____��������ĸ��
A.ͭ˿ B. AgI C. ϡ���� D. �ɱ� E. ��ˮ F. ������ G. Ba(OH)2��8H2O H. Fe(OH)2 I. ����
��2����ϱ��и����ĵ���ƽ�ⳣ���ش��������⣺
�� | CH3COOH | HNO2 | HCN | HClO |
����ƽ�ⳣ��(Ka) | 1.8��10-5 | 4.6��10-4 | 5��10-10 | 3��10-8 |
�������������У�������������ǿ����ֱ���_______��_______���û�ѧʽ��ʾ����
��������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ�����__________������ţ���
A.�����¶� B.��ˮϡ�� C.��������CH3COONa���� D.������������ E.���������ƹ���
�����ϱ������жϴ���ʹ���������Һ�ܷ�Ӧ��������ܷ�Ӧ˵�����ɣ�����ܷ�����Ӧ��д����Ӧ�����ӷ���ʽ___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Cu��Zn��ϡ������ɵ�ԭ���װ�ã�����˵����ȷ���ǣ� ��
A.пƬ������
B.�ɽ�����ת��Ϊ��ѧ��
C.��Ӧʱ����Һ��c��H+����С
D.��Ӧʱ��ͭƬ������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com