
����Ŀ����1����������������ǿ����ʵ���______������������ʵ���______�����ڷǵ���ʵ���_____��������ĸ��
A.ͭ˿ B. AgI C. ϡ���� D. �ɱ� E. ��ˮ F. ������ G. Ba(OH)2��8H2O H. Fe(OH)2 I. ����
��2����ϱ��и����ĵ���ƽ�ⳣ���ش��������⣺
�� | CH3COOH | HNO2 | HCN | HClO |
����ƽ�ⳣ��(Ka) | 1.8��10-5 | 4.6��10-4 | 5��10-10 | 3��10-8 |
�������������У�������������ǿ����ֱ���_______��_______���û�ѧʽ��ʾ����
��������ʹ������Һ��CH3COOH�ĵ���̶���������ƽ�ⳣ������IJ�����__________������ţ���
A.�����¶� B.��ˮϡ�� C.��������CH3COONa���� D.������������ E.���������ƹ���
�����ϱ������жϴ���ʹ���������Һ�ܷ�Ӧ��������ܷ�Ӧ˵�����ɣ�����ܷ�����Ӧ��д����Ӧ�����ӷ���ʽ___________________________________��
���𰸡�BG FH DI HCN HNO2 BE CH3COOH + ClO��= HClO + CH3COO��
��������
��1��ǿ��������ʵ�������������ˮ��Һ���ܷ���ȫ���룬����ʺͷǵ���ʶ�ָ���ǻ����D. �ɱ���I. ���DZ��������룬���ǻ���������Ƿǵ���ʣ�
A.ͭ˿�ǵ��ʣ��Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�C. ϡ���ᡢE. ��ˮ���ǻ����Ȳ��ǵ����Ҳ���Ƿǵ���ʣ�
���ᡢ��ζ��ǵ������������B. AgI��F. ��������G. Ba(OH)2��8H2O��H. Fe(OH)2���ǵ���ʣ�AgI�����ܽ��С����������Ũ��С����Ȼ��Һ�������������ܽ�IJ�����ȫ���룬����B. AgI�����ǵ���ʣ�������ǿ����ʡ�G. Ba(OH)2��8H2O��ǿ����ʣ�
F. ��������ˮ��Һ��ֻ�ܲ��ֵ��룬����������ʣ�H. Fe(OH)2��ˮ��Һ�в��ֵ��룬��������ʣ�
�ʴ�Ϊ��BG��FH��DI��
��2������������HCN�ĵ���ƽ�ⳣ����С����HCN����������HNO2�ĵ���ƽ�ⳣ�������HNO2����ǿ��
�ڸ��ݴ���ĵ���ƽ�⣺CH3COOH![]() CH3COO-+H+��
CH3COO-+H+��
A�������¶ȣ�����̶�������ƽ�ⳣ������ѡ��A����
B����ˮϡ�ͣ�����̶�������ƽ�ⳣ�����䣬ѡ��B��ȷ��
C����������CH3COONa���壬������Ĵ�����Դ���ĵ���ƽ�����������ã�����̶ȼ�С������ƽ�ⳣ�����䣬ѡ��C����
D�������������ᣬ�����Ũ��������ԽϡԽ�������ʵ�������̶ȼ�С��ƽ�ⳣ�����䣬ѡ��D����
E.���������ƹ��壬������������������������ӵķ�Ӧ��ʹ��Һ��������Ũ�Ƚ��ͣ��ٽ�����ĵ��룬CH3COOH�ĵ���̶������¶Ȳ��䣬����ƽ�ⳣ�����䣬ѡ��E��ȷ��
��ѡBE��
����������CH3COOH> HClO��������ǿ�����������ĸ��ֽⷴӦ���ɣ�����ʹ���������Һ�ܷ�Ӧ����Ӧ�����ӷ���ʽΪCH3COOH + ClO��= HClO + CH3COO����


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ѧ��ѧ�г����ڻ����ķ�����ᴿ��װ�ã������װ�ûش����⣺
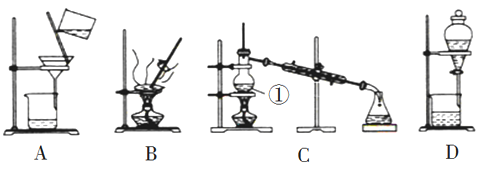
��1����װ��A��װ��B�ж��õ���������װ��A�в�������������__________װ��B�в��������Ͻ��裬��������_________
��2�����Ȼ�����Һ�еõ��Ȼ��ƹ��壬ѡ��װ��__________�������װ��ͼ����ĸ����
��3��װ��C�Тٵ�������__________�����м����ʯ��������_________����ȴˮ�ķ�����_____________________
��4����֪���ڳ����£�����C6H6��Ϊһ����ɫ������Һ�壬�ܶ�Ϊ 0.8786 g/cm3�� ���Խϸߣ��ӷ�����ȼ���и�ʴ�ԣ��е�Ϊ 80.1�棬������ˮ���������л��ܼ�������Ϊ�л��ܼ����⣨I2��Ϊ�Ϻ�ɫ���壬�����������������۵� 113.5�棬�е� 184.3�棬����ʱ������Ϊ��ɫ��������ȴ���������Ϻ�ɫ���壮ʵ���ҳ��ñ�����ȡ��ˮ�еĵ⣬Ȼ���Һ����������ı���Һ���õ����ʵ⡣ ���в���װ��C�����ı���Һʱ����ˮԡ����װ��C�������٣�����Ϊ��ֱ�Ӽ��ȵ�ԭ����_______��ͬʱ��ƿ����ʢ�б�ˮ���ձ��У�����Ϊ��Ŀ����________
��5�������к��зḻ�ĵ⣬Ϊ�˴Ӻ�������ȡ�⣬��һ�������պ������˲�������Ҫ���ż��⣬����Ҫ�õ����е�ʵ��������____________
A���ձ� B������ C�������� D�������� E���ƾ��� F������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. �ڱ�״���£�11.2Lij���������Ϊ22g������������Է���������44g/mol
B. 16gO2��16gO3������ԭ�Ӹ���һ����
C. �ڱ�״���£�ˮ�������͵������Ӽ��ƽ���������
D. �ڱ�״���£�1molSO3�����ԼΪ22.4L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Ni2O3)������������ܵ��Ԫ������ⷨ�Ʊ��������£���NaOH��Һ��NiCl2��Һ��pH����7.5���������������ƹ�������е�⡣�������в�����Cl2������������������ClO-���Ѷ�����(�ɼ�д��Ni2+)����ΪNi3+���ٽ�Ni3+��һϵ�з�Ӧ��ת��ΪNi2O3�����װ����ͼ��ʾ������˵������ȷ����(����)

A. �������������Ƶ���������������Ũ�ȣ���ǿ��Һ�ĵ�������
B. ������������������Һ��pH����
C. �������У���Һ�е�Cl-�������ӽ���Ĥ�������ƶ�
D. ClO-����Ni2+�����ӷ���ʽΪ��ClO-+H2O+2Ni2+=Cl-+2Ni3++2OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���ӦHX(g)![]() 1/2H2(g)+ 1/2X2(g) ��ƽ�ⳣ��Ϊ0.1�����������ʵ�����H2(g)��X2(g)ͨ�����Ϊ1L���ܱ������У��ڸ��¶���HX(g)�������ʽӽ���( )
1/2H2(g)+ 1/2X2(g) ��ƽ�ⳣ��Ϊ0.1�����������ʵ�����H2(g)��X2(g)ͨ�����Ϊ1L���ܱ������У��ڸ��¶���HX(g)�������ʽӽ���( )
A. 83% B. 17% C. 5% D. 33%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪2A2(g)+B2(g)![]() 2C3(g)����H=��Q1 kJ/mol(Q1>0)�� ��һ���д������ݻ�������ܱ������м���2 molA2��1 molB2����500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw mol��L��1���ų�����ΪQ2 kJ��
2C3(g)����H=��Q1 kJ/mol(Q1>0)�� ��һ���д������ݻ�������ܱ������м���2 molA2��1 molB2����500��ʱ��ַ�Ӧ����ƽ���C3��Ũ��Ϊw mol��L��1���ų�����ΪQ2 kJ��
��1���ﵽƽ��ʱ�� A2��ת����Ϊ____________������Q1 ��Q2��ʾ��
��2���ﵽƽ�������ԭ������ͨ�������������A2��ת���ʽ�________(����������������С������������)
��3������ԭ���������У�ֻ����2mol C3 ��500��ʱ��ַ�Ӧ��ƽ�����������Q3 kJ����Q1��Q2��Q3 ֮��������ֹ�ϵ��Q3=____________��
��4����˵���÷�Ӧ�Ѿ��ﵽƽ��״̬����_______
A��v��C3��=2v��B2�� B��������ѹǿ���ֲ���
C��A2 �� B2 ��ת������� D�������ڵ������ܶȱ��ֲ���
��5���ı�ijһ�������õ���ͼ��ʾ�ı仯����(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)���ɵó��Ľ�����ȷ����____________������ţ�

A����Ӧ������c��b��a B���ﵽƽ��ʱA2��ת���ʴ�СΪ��b��a��c
C��T2��T1
��6����������������Ϊ��ѹ����������ʼʱ����2 molA2��1 molB2��500��ʱ��ַ�Ӧ��ƽ��ų�����Q4 kJ����Q2__________Q4(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�������ȷ���ǣ� ��
A. ���������� B. ϡ��Ũ����
B. ϡ��Ũ����
C. ���˲��� D. �ⶨ��ҺpH
D. �ⶨ��ҺpH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д��ľ̿��Ũ���ᷴӦ�Ļ�ѧ����ʽ____��
Ϊ����֤�����еĶ�����̼���壬�ס�����ͬѧ�ֱ��������ʵ�飨��֪Br2+2H2O+SO2=H2SO4+2HBr����
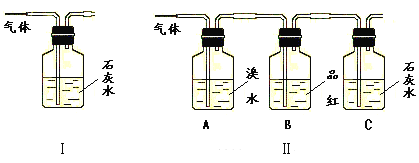
��ش��������⣺
��1���ܷ���ݢ�װ����ʯ��ˮ����ǵ�����˵��������һ���ж�����̼���壿___��������____��
��2����װ����A��������___��B��������___��
��3������B��Ʒ��__��C�в���___��˵��������һ���ж�����̼���塣
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com