
【题目】对于平衡体系mA(g)+nB(g)![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
pC(g)+qD(g) ΔH<0。下列结论中错误的是( )
A. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
B. 若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的1.8倍,则m+n > p+q
C. 若m+n = p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若温度不变缩小容器体积,达到新平衡时压强增大到原来的2倍,则体积一定小于原来的1/2
【答案】D
【解析】
A、反应开始时,A、B的物质的量之比为m∶n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,正确;B、将容器的体积缩小到原来的一半,不考虑平衡移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的1.8倍,说明平衡向着消耗A的方向移动,体积缩小即增大压强,平衡向着气体体积减小的方向进行,所以m+n > p+q,正确;C、往含有a mol气体的平衡体系中再加入a mol的B,平衡向正反应移动,因为m+n = p+q,达到新平衡时混合气体总的物质的量不变,达到新平衡时气体的总物质的量等于2a mol,正确;D、如果m+n=p+q,温度不变时,若压强增大到原来的2倍,达到新平衡时,总体积等于原来的1/2,错误;故选D。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.摩尔是七个基本物理量之一
B.1 mol任何物质都含有6.02×1023个分子
C.标准状况下,1 mol任何物质体积均为22.4 L
D.摩尔质量在数值上等于该物质的相对分子质量或相对原子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的表示及说法正确的是( )
A.已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
B.含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
H2SO4 (aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol
C.已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定
D.已知I2(g)+H2(g)=2HI(g)△H1<0;I2(s)+H2(g)=2HI(g )△H2<0,则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)铝合金在航空领域应用广泛,回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_____,其中s轨道上总共有______个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____,配位体____。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是___________________________。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为 __________________ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物与生产、生活关系密切.已知t℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25.若在2L密闭容器中加入0.02mol FeO(s),并通入xmolCO,t℃时反应达到平衡.此时FeO(s)转化率为50%,则x的值为( )
A.0.1
B.0.05
C.0.04
D.0.02
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(33As)在周期表中与氮同主族,砷及其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷化氢的电子式为_________。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式_____________________。
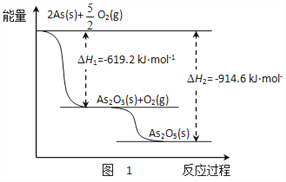
(3)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式________________________________________。
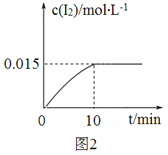
(4)砷酸钠(Na3AsO4)具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①0~10 min内,I的反应速率v(I)=______________。
②在该条件下,上述反应的平衡常数K=__________。
③升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(5)己知砷酸(H3ASO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c(HAsO42-)___c(H3AsO4)(填“>”、“<”或“=”)。
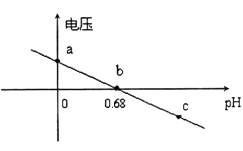
②某实验小组依据反应AsO43-+2H++2I-AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图。则a点时,盐桥中K+____移动(填“向左”、“向右”或“不”),c点时,负极的电极反应为____________________。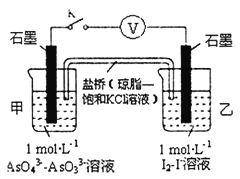
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化学工业基础原料和清洁液体燃料.工业上可利用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如表所示:
化学反应 | 平衡 | 温度/℃ | |
500 | 800 | ||
①2H2(g)+CO(g)CH3OH(g) | K1 | 2.5 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g) | K3 | ||
(1)据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示).500℃时测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(molL﹣1)分别为0.8、0.1、0.3、0.15,则此时v正v逆(填“>”、“=”或“<”).
(2)对于反应③,在相同温度和容积不变时,能说明该反应已达平衡状态的是
A.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3:1
D.容器内的密度保持不变.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中:2A(g)+B(g)![]() 2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
2C(g)+D(g),若最初加入的A和B都是4mol,在前10s A的平均反应速率为0.12mol/(L·s),则10s时,容器中B的物质的量是( )
A. 3.4 mol B. 3.2 mol C. 2.8 mol D. 1.2 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com