
����Ŀ���״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϣ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�������ʾ��
��ѧ��Ӧ | ƽ�� | �¶�/�� | |
500 | 800 | ||
��2H2��g��+CO��g��CH3OH��g�� | K1 | 2.5 | 0.15 |
��H2��g��+CO2��g��H2O��g��+CO��g�� | K2 | 1.0 | 2.50 |
��3H2��g��+CO2��g��CH3OH��g��+H2O��g�� | K3 | ||
��1���ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3=����K1��K2��ʾ����500��ʱ��÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O��g����Ũ�ȣ�molL��1���ֱ�Ϊ0.8��0.1��0.3��0.15�����ʱv��v�������������=����������
��2�����ڷ�Ӧ�ۣ�����ͬ�¶Ⱥ��ݻ�����ʱ����˵���÷�Ӧ�Ѵ�ƽ��״̬����
A.n��CO2����n��H2����n��CH3OH����n��H2O��=1��3��1��1
B.������ѹǿ���ֲ���
C.H2������������CH3OH����������֮��Ϊ3��1
D.�����ڵ��ܶȱ��ֲ��䣮
���𰸡�
��1��K1?K2,��
��2��B,C
���������⣺��1����Ӧ��3H2��g��+CO2��g���TCH3OH��g��+H2O��g�������������С�ķ�Ӧ��S��0�����ݷ�Ӧ��+�ڵõ���Ӧ�ۣ�����ƽ�ⳣ��K3=K1��K2������¶ȱ仯���������¶����ߣ�ƽ�ⳣ����С��ƽ��������У������жϷ�Ӧ�Ƿ��ȷ�Ӧ���ʱ��H��0����500�桢2L���ܱ������У����з�Ӧ�ۣ���÷�Ӧ����ijʱ�̣�H2��g����CO2��g����CH3OH��g����H2O ��g����Ũ�ȣ�mol/L���ֱ�Ϊ0.8��0.1��0.3��0.15��Q= ![]() =0.87��K=2.5����Ӧ������У�V����V�棬
=0.87��K=2.5����Ӧ������У�V����V�棬
��2��A��n��CO2����n��H2����n��CH3OH����n��H2O��=1��3��1��1�������ж����淴Ӧ�����Ƿ���ȣ����ж��Ƿ�ﵽƽ��״̬����A����
B���÷�Ӧ�������С�ķ�Ӧ��������ѹǿ���ֲ��䣬�������淴Ӧ������ȣ�����ֵ�Ũ�Ȳ��ٱ仯���ﵽ��ƽ��״̬����B��ȷ��
C��H2������������CH3OH����������֮��Ϊ3��1����ʾ�������淴Ӧ���ʣ��������������ϵ��˵���ﵽ��ƽ��״̬����C��ȷ��
D�������ڵ��ܶȱ��ֲ��䣬��Ӧ����ʽ���߶������壬��������������䣬�������ݻ��̶������Է�Ӧ������������ܶ�ʼ�ղ��䣬�����ܶȲ�����Ϊ�ж�ƽ��״̬�����ݣ���D����
���Դ��ǣ���1��K1K2��������2��BC
�����㾫�������ڱ��⿼��Ļ�ѧƽ��״̬���жϺͻ�ѧƽ��ļ��㣬��Ҫ�˽�״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ���Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%���ܵó���ȷ�𰸣�


 ��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
��˼ά������ҵ���ټ��ִ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����Ķ�������ͺ�0.7 mol�����Ŀ���(����CO2)����һ��������ܱ������У�550��ʱ���ڴ��������·�����Ӧ2SO2��O2![]() 2SO3����Ӧ�ﵽƽ��������еĻ������ͨ����������������Һ�����������С��21.28 L���ٽ�ʣ������ͨ��һ�ּ�����Һ�������������������ּ�����5.6 L(�������������Ϊ��״���µ����)��(����������һλС��)��ش��������⣺
2SO3����Ӧ�ﵽƽ��������еĻ������ͨ����������������Һ�����������С��21.28 L���ٽ�ʣ������ͨ��һ�ּ�����Һ�������������������ּ�����5.6 L(�������������Ϊ��״���µ����)��(����������һλС��)��ش��������⣺
(1)�жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��(����ĸ)__________________��
a�������������������Ũ�����
b����������ٷֺ������ֲ���
c�������������ѹǿ����
d����������������������������������������
e�������л��������ܶȱ��ֲ���
(2)��÷�Ӧ�ﵽƽ��ʱ�����Ķ�����������ʵ���ռԭ������������ʵ����İٷֱ�____��
(3)����ƽ���������5%ͨ��������Ȼ�����Һ�У����ɳ����������Ƕ��٣�______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ����ϵmA(g)��nB(g)![]() pC(g)��qD(g) ��H��0�����н����д������( )
pC(g)��qD(g) ��H��0�������������( )
A. ��ƽ��ʱ��A��B��ת������ȣ�˵����Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm��n
B. ���¶Ȳ��䣬�������������С��ԭ����һ�룬�ﵽ��ƽ��ʱA��Ũ��Ϊԭ����1.8������m��n > p��q
C. ��m��n = p��q����������a mol�����ƽ����ϵ���ټ���a mol��B���ﵽ��ƽ��ʱ������������ʵ�������2a
D. ���¶Ȳ�����С����������ﵽ��ƽ��ʱѹǿ����ԭ����2���������һ��С��ԭ����1/2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2SO2(g)+O2(g)![]() 2SO3(g) ��H =-198kJ/mol����V2O5����ʱ���÷�Ӧ����Ϊ:V2O5+SO2��2VO3+SO3(��)��4VO2+O2��2V2O5(��)
2SO3(g) ��H =-198kJ/mol����V2O5����ʱ���÷�Ӧ����Ϊ:V2O5+SO2��2VO3+SO3(��)��4VO2+O2��2V2O5(��)
A. ��Ӧ������Ҫȡ����V2O5������ B. VO2�Ǹ÷�Ӧ�Ĵ���
C. �÷�Ӧ�淴Ӧ�Ļ�ܴ���198kJ/mol D. �����¶ȣ��÷�Ӧ�ġ�H����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������I2O5������CO��Ⱦ�����ⶨCO����ӦΪ��
5CO��g��+I2O5��s��5CO2��g��+I2��s������H 1
��1����֪��2CO��g��+O2��g��2CO2��g������H 2
2I2��s��+5O2��g��2I2O5��s������H 3
���H 1=���ú���H 2�͡�H 3�Ĵ���ʽ��ʾ����
��2����ͬ�¶��£���װ������I2O5�����2L�����ܱ�������ͨ��2molCO�����CO2����������գ�CO2����ʱ��t�仯������ͼ��
��ش�
��c������Ӧ�����淴Ӧ���ʣ�����ڡ��������ڡ���С�ڡ�����a���淴Ӧ����d���淴Ӧ���ʣ�����ڡ��������ڡ���С�ڡ���
������˵����ȷ���� �� ������ĸ��ţ���˫ѡ��
A�������������ܶȲ��䣬������Ӧ�ﵽƽ��״̬
B�������¶��£�c��ʱ��ϵ�л�������ƽ����Է����������
C������I2O5��Ͷ�������������CO��ת����
D��b���d��Ļ�ѧƽ�ⳣ����Kb��Kd ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������գ�
��1��ij�¶�ʱ�����0.01molL��1��NaOH��Һ��pH=11������¶���ˮ�����ӻ�����KW= �� ���¶�25�森�����������=��������
��2���ڣ�1�������¶��£���pH=12��NaOH��ҺVa L��pH=2������Vb L��ϣ������û��Һ��pH=10����Va��Vb= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��Ũ�ȵ�Ba(OH)2��Һ�е���ijŨ�ȵ�NH4HSO4��Һ���䵼�������������Һ����ı仯��ͼ��ʾ������˵����ȷ����
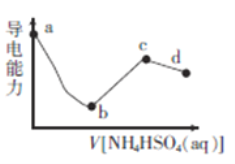
A. b����Һ��ֻ����H2O�ĵ���ƽ���BaSO4�ij����ܽ�ƽ��
B. ab�η�Ӧ�����ӷ���ʽΪBa2++OH-+H++SO42-=BaSO4��+H2O
C. C����Һ����c(H+)+c(NH4+)=c(NH3��H2O)+c(OH-)
D. bc��֮�����ij��������Һ����c(NH4+)=2c(SO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У��������Ӽ����й��ۼ����ǣ� ��
A.CaCl2
B.MgO
C.HNO3
D.NH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ�������ȷ�Ӧ���ǣ� ��
A.NH4Cl��Ba��OH��28H2O��ĥ
B.��ʯ������ˮ
C.þ��ϡ���ᷴӦ
D.����ȼ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com