
| ʱ��t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| ��ѹǿp/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| ��Ӧʱ��t/h | 0 | 4 | 8 | 16 |
| C��A��/��mol?L-1�� | 0.10 | a | 0.026 | 0.0065 |
| P-P0 |
| P 0 |
| P |
| P0 |
| 9.53-4.91 |
| 4.91 |
| c(B)?c(C) |
| c(A) |
| 0.09412 |
| 0.10��(1-94.1%) |
| P |
| P0 |
| c(B)?c(C) |
| c(A) |
| 0.09412 |
| 0.10��(1-94.1%) |
| 0.10P |
| P0 |
| 0.10(P-P0) |
| P0 |
| 0.10(P-P0) |
| P0 |
| p |
| po |
| 0.10(P-P0) |
| P0 |
| P |
| P0 |
| p |
| po |
| P |
| P0 |
| P |
| P0 |
| 7.31 |
| 4.91 |
| 0.026mol/L |
| 2 |


 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������ڸ�������һ����̼��Ӧ |
| B��������̼������������Һ��������̼���� |
| C��Zn����ϡ���ᷴӦ��ȡ���� |
| D��̼������Һ����ʯ�һ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ԭ�Ӱ뾶��X��Y��W��Z |
| B��ԭ��������Y��X��Z��W |
| C��ԭ��������������Z��W��Y��X |
| D�����Ӱ뾶��X+��Y2+��W2-��Z- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
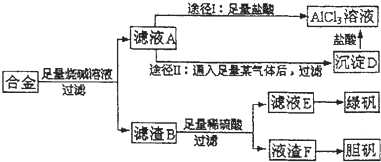
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cu2+��Mg2+��SO42-��Cl- |
| B��Na+��H+��Fe2+��NO3- |
| C��Ba2+��K+��SO42-��Cl- |
| D��Na+��Ca2+��HCO3-��OH- |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com