
【题目】通常把原子总数和价电子总数相同的分子或离子称为等电子体.人们发现等电子体的空间结构相同,则下列有关说法中正确的是( )
A.B3N3H6分子中存在双键,可发生加成反应
B.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
C.NH3和PCl3是等电子体,均为三角锥形结构
D.BF3和CO![]() 是等电子体,均为平面正三角形结构
是等电子体,均为平面正三角形结构
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关反应热的叙述中正确的是 ( )
①已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ· mol-1,则氢气的燃烧热ΔH=-241.8 kJ· mol-1
②由单质A转化为单质B是一个吸热过程,由此可知单质B比单质A稳定
③X(g)+Y(g)![]() Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
Z(g)+W(s) ΔH>0,恒温恒容条件下达到平衡后加入X,上述反应的ΔH增大
④已知:下表数据可以计算出![]() (g)+3H2(g)
(g)+3H2(g)![]()
![]() (g)的焓变
(g)的焓变
共价键 | C—C | C=C | C—H | H—H |
键能/(kJ·mol-1) | 348 | 610 | 413 | 436 |
⑤根据盖斯定律可推知在相同条件下,金刚石或石墨燃烧生成1 mol CO2(g)时,放出的热量相等
⑥25 ℃、101 kPa时,1 mol碳完全燃烧生成CO2(g)所放出的热量为碳的燃烧热
A.①②③④B.③④⑤C.④⑤D.⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向盛50mL0.100mol·L-1盐酸的两个烧杯中各自匀速滴加50mL的蒸馏水、0.100mol·L-1醋酸铵溶液,测得溶液pH随时间变化如图所示。已知Ka(CH3COOH)=1.8×10-5,Kb(NH3·H2O)=1.8×10-5。下列说法正确的是( )
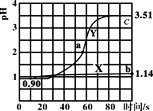
A.曲线X是盐酸滴加蒸馏水的pH变化图,滴加过程中溶液各种离子浓度逐渐减小
B.曲线Y上的任意一点溶液中均存在c(CH3COO-)<c(NH4+)
C.a点溶液中n(Cl-)+n(CH3COO-)+n(OH)-n(NH4+)=0.01mol
D.b点溶液中水电离的c(H+)是c点的102.37倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。

(1)在右图装置中,观察到装置甲铜电极上产生大量的无色气体; 而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论是__________________。
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____________________________________。

(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(Ⅵ)转化为Cr (Ⅲ) 常见的处理方法是电解法和铁氧磁体法。
①电解法: 将含Cr2O72- 的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaCl 进行电解,使阳极生成的Fe2+和Cr2O72- 发生反应,其离子方程式为_______________。阴极上Cr2O72- 、H+、Fe3+都可能放电。若Cr2O72- 放电,则阴极的电极反应式为_________; 若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀,已知:Cr3+![]() Cr(OH)3
Cr(OH)3![]() CrO2-,则阴极区溶液pH 的范围为_________。
CrO2-,则阴极区溶液pH 的范围为_________。
②铁氧磁体法: 在含Cr (Ⅵ) 的废水中加入绿矾,在pH<4时发生反应使Cr (Ⅵ) 转化为Cr (Ⅲ),调节溶液pH 为6~8,使溶液中的Fe (Ⅱ)、F e(Ⅲ)、Cr (Ⅲ)析出组成相当于Fe(Ⅱ) [Fe(Ⅲ)x·Cr (Ⅲ)2-x] O4(铁氧磁体) 的沉淀,则铁氧磁体中x=_________; 若废水中Cr (Ⅵ) 以CrO3计,用该法除去废水中的Cr (Ⅵ),加入的FeSO4·7H2O 与CrO3的质量比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)丙酮(CH3COCH3)分子中2号碳原子轨道的杂化类型是__,1mol丙酮分子中含有σ键的数目为___mol。
(2)C、H、O三种元素的电负性由小到大的顺序为__。(请填写元素名称,不要加任何连接符号)
(3)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为__。
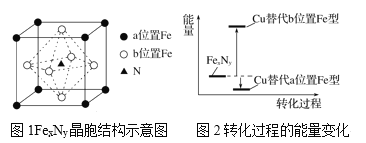
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+![]() O2(g)=CO(g) △H2
O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H1 S(g)+O2(g)=SO2(g) △H2
③H2(g)+![]() O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
O2(g)=H2O(l) △H1 2H2(g)+O2(g)=2H2O(l) △H2
④CaCO3(s)=CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)=Ca(OH)2(s) △H2
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A. c(OH-)/c(NH3·H2O) B. n(OH-)
C. c(NH3·H2O)/c(OH-) D. c(H﹢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴主要用作颜料、釉料及磁性材料,利用铜钴矿石制备Co2O3的工艺流程如图所示。
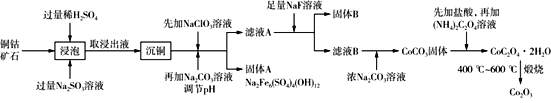
已知:铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。请回答下列问题:
(1)“浸泡”过程中可以加快反应速率和提高原料利用率的方法是_______(写出2种即可)。
(2)“浸泡”过程中,加入Na2SO3溶液的主要作用是____________。
(3)向“沉铜”后的滤液中加入NaClO3溶液,写出滤液中的金属离子与NaClO3反应的离子方程式________________。
(4)温度、pH对铜、钴浸出率的影响如图1、图2所示:
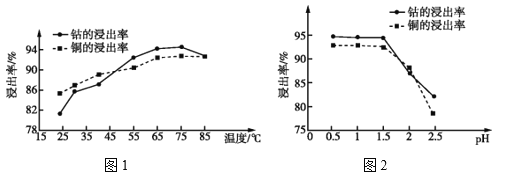
①“浸泡”铜钴矿石的适宜条件为__________________。
②图2中pH增大时铜、钴浸出率下降的原因可能是___________。
(5)CoC2O4·2H2O在空气中高温煅烧得到Co2O3的化学方程式是________。
(6)一定温度下,向滤液A中加入足量的NaF溶液可将Ca2+、Mg2+沉淀而除去,若所得滤液B中c(Mg2+)=1.0×10-5 mol/L,则滤液B中c(Ca2+)为______。[已知该温度下Ksp(CaF2)=3.4×10-11,Ksp(MgF2)=7.1×10-11]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com