
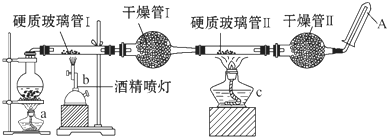
 在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物
在常温下,Fe与水并不起反应,但在高温下,Fe可与水蒸气发生反应.应用下列装置,试探究反应的部分产物.在硬质玻璃管Ⅰ中放入还原铁粉和石棉绒的混合物,硬质玻璃管Ⅱ中加入CuO.干燥管Ⅱ中盛装的物质是无水硫酸铜和石棉绒的混合物分析 由图可知,圆底烧瓶提高水蒸气,硬质玻璃管Ⅰ中发生3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,生成氢气具有可燃性,点燃时需要验纯,干燥管Ⅰ中碱石灰干燥氢气,硬质玻璃管Ⅱ中氢气还原CuO,干燥管Ⅱ中无水硫酸铜和石棉绒的混合物为检验水的生成,最后用向下排空法收集多余的氢气.
(1)由图可知,圆底烧瓶提高水蒸气,烧瓶底部放置了几片碎瓷片是防止加热液体暴沸;
(2)根据氢气不纯加热时会发生爆炸分析;
(3)硬质玻璃管Ⅱ中氢气还原CuO生成铜和水;
(4)干燥管Ⅰ为干燥氢气;干燥管Ⅱ为检验有水生成;
(5)铁和水蒸气反应生成四氧化三铁和氢气.
解答 解:(1)由图可知,圆底烧瓶提高水蒸气,烧瓶底部放置了几片碎瓷片是防止加热液体暴沸,所以圆底烧瓶中盛装水,该装置受热后的主要作用是制备水蒸气;向烧瓶中放置了几片碎瓷片,其作用是防止暴沸,故答案为:水,制备水蒸气,防止暴沸;
(2)因为氢气不纯加热时会发生爆炸,所以应先点燃a处的加热装置,让产生的水蒸气排净装置中的空气,故答案为:a;
(3)硬质玻璃管Ⅱ中氢气还原CuO生成铜和水,方程式为:H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,现象为:黑色固体变红,试管壁上有水珠,
故答案为:黑色固体变红,试管壁上有水珠;H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O;
(4)干燥管Ⅰ为干燥氢气,装的为碱石灰,作用干燥H2,干燥管Ⅱ为无水硫酸铜和石棉绒的混合物为检验水的生成,则实验现象是白色固体变蓝,
故答案为:碱石灰;干燥H2;白色固体变蓝;
(5)根据以上分析,铁和水蒸气反应生成四氧化三铁和氢气,化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,故答案为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
点评 本题考查了物质的制备、物质成分的探究实验,题目侧重于考查学生的实验探究能力,注意把握铁及其化合物的性质,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
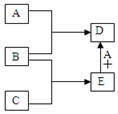 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
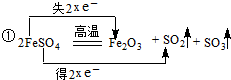 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
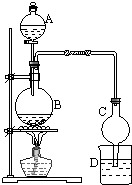 (1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.
(1)某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓硫酸,B中盛有乙醇、乙酸,D中盛有饱和碳酸钠溶液.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ③ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 溶液最终变为蓝色 | 2Fe3++2I-═2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为放热反应 | |
| B. | 氢氧燃料电池使用时是将热能转化成电能 | |
| C. | 人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 | |
| D. | 太阳能光电池将太阳能直接转换为电能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com