
���� ��һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
3A��g��+B��g��?xC��g��+2D��g��
��ʼ����mol����2 2 0 0
�仯����mol����1.2 0.8 0.8 0.8
ƽ������mol����0.8 1.2 0.8 0.8
��1��ƽ��ʱC��Ũ��Ϊ0.4mol/L����n��C��=0.4mol/L��2L=0.8mol�����n��D���������ʵ���֮�ȵ��ڻ�ѧ������֮�ȼ���x��
��2������ƽ��ʱn��D�����ɷ���ʽ��֪�μӷ�Ӧ��n��A��=$\frac{3}{2}$n��D�����ٸ���ת���ʶ������A��ת���ʣ�
��3�����ݷ�Ӧ���ʸ������v=$\frac{��c}{��t}$��
��4����Ӧǰ������������䣬����ѹǿƽ�ⲻ����
��� �⣺��һ���¶��£���2molA��2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
3A��g��+B��g��?xC��g��+2D��g��
��ʼ����mol����2 2 0 0
�仯����mol����1.2 0.8 0.8 0.8
ƽ������mol����0.8 1.2 0.8 0.8
��1��ƽ��ʱC��Ũ��Ϊ0.4mol/L����n��C��=0.4mol/L��2L=0.8mol�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�����0.8mol��0.8mol=x��2�����x=2��
�ʴ�Ϊ��2��
��2��ƽ��ʱn��D��=0.8mol���ɷ���ʽ��֪�μӷ�Ӧ��n��A��=$\frac{3}{2}$n��D��=$\frac{3}{2}$��0.8mol=1.2mol����A��ת����Ϊ$\frac{1.2mol}{2mol}$��100%=60%��
�ʴ�Ϊ��60%��
��3������D�ķ�Ӧ����=$\frac{\frac{0.8mol}{2L}}{2min}$=0.2mol/L•min��
�ʴ�Ϊ��0.2mol/L•min��
��4����Ӧǰ����������ʵ������䣬����ѹǿ��ƽ�ⲻ�ƶ���ƽ����ϵ��C�������������䣬
�ʴ�Ϊ�����䣮
���� ���⿼�黯ѧƽ�������Ӱ�����ص�֪ʶ��Ϊ�߿��������ͣ�������ѧ���ķ��������ͼ��������Ŀ��飬ע���������ʽ�������ã��ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ʹ��ϡ��Һ | B�� | ѡ����ʵĴ��� | ||
| C�� | ��ϸ���巴Ӧ�� | D�� | ��߷�Ӧ��ϵ���¶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
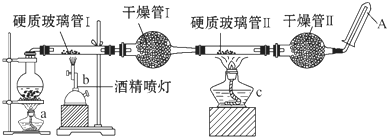 �ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe����ˮ����������Ӧ��Ӧ������װ�ã���̽����Ӧ�IJ��ֲ����Ӳ�ʲ����ܢ��з��뻹ԭ���ۺ�ʯ���Ļ���Ӳ�ʲ����ܢ��м���CuO������ܢ���ʢװ����������ˮ����ͭ��ʯ���Ļ����
�ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe����ˮ����������Ӧ��Ӧ������װ�ã���̽����Ӧ�IJ��ֲ����Ӳ�ʲ����ܢ��з��뻹ԭ���ۺ�ʯ���Ļ���Ӳ�ʲ����ܢ��м���CuO������ܢ���ʢװ����������ˮ����ͭ��ʯ���Ļ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
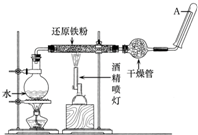 �ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ������Ӧ��ʵ�顱��
�ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ������Ӧ��ʵ�顱���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
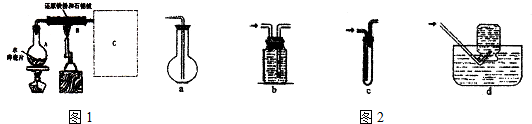
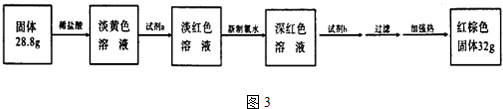
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
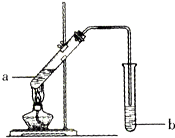 ��ͼΪʵ�����Ʊ������Ҵ�װ�ã�
��ͼΪʵ�����Ʊ������Ҵ�װ�ã�| ���� | �۵�/�� | �е�/�� | �ܶ�/g•cm-3 |
| �Ҵ� | -114 | 78 | 0.789 |
| ���� | 16.6 | 117.9 | 1.05 |
| �������� | -83.6 | 77.5 | 0.900 |
| ŨH2SO4 | 338 | 1.84 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��CO��=1.2 mol/��L•s�� | B�� | v��NO2��=0.3 mol/��L•min�� | ||
| C�� | v��N2��=0.6 mol/��L•min�� | D�� | v��CO2��=1.2 mol/��L•min�� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com