
| A. | 标准状况下,1molNa2O2和22.4LCO2反应,转移电子数为1mol | |
| B. | 将钠投入到CuSO4溶液中,可以置换生成Cu | |
| C. | 将Na2O2投入到FeSO4溶液中,可生成红褐色沉淀 | |
| D. | 常温下铜与稀硫酸不反应,加入KNO3晶体后,可生成气体 |
分析 A.2Na2O2+2H2O=4NaOH+O2↑,每生成1molO2时反应中转移的电子为2mol;
B.金属活动顺序表中,前边的金属会把后边的金属从其盐溶液中置换出来,但是活泼金属钾、钠是先和溶液中的水发生反应;
C.Na2O2投入FeCl2溶液反应中Na2O2和水反应,生成的氢氧化钠和氧气,氢氧化钠再与氯化亚铁反应生成氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁;
D.根据铜的化学性质,如:铜不能与非氧化性酸反应,但可以和氧化性酸、酸性条件下硝酸盐等反应,常温下铜与稀硫酸不反应加入KNO3晶体后形成稀硝酸.
解答 解:A.2Na2O2+2H2O=4NaOH+O2↑,每生成1molO2时2molNa2O2与水完反应中转移的电子为2NA,标准状况下,1molNa2O2和22.4LCO2反应,二氧化碳物质的量为1mol,恰好和过氧化钠反应转移电子数为1mol,故A正确;
B.金属钠和铜的盐溶液反应时,先是和水反应置换出氢气,然后是氢氧化钠和铜盐之间的反应,不会置换出金属铜,故B错误;
C.将Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,2NaOH+FeCl2=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+H2O=4Fe(OH)3,4Fe(OH)2是白色沉淀易被氧化为红褐色的Fe(OH)3沉淀,所以看到的现象是:有大量气泡生成,出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,故C正确;
D.常温下铜与稀硫酸不反应加入KNO3晶体后形成稀硝酸,铜与稀HNO3反应,反应的离子方程式:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,可知Cu遇到H+、NO3-能发生氧化还原反应,生成一氧化氮气体,故D正确;
故选B.
点评 本题考查的是钠化合物的性质、氢氧化钠的性质,正确分析反应过程是解本题的关键,注意Na2O2、Na投入CuSO4溶液中观察到的现象分析判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
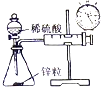 |  |  | 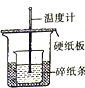 |
| A.测量锌与稀硫酸反应的速率 | B.证明非金属性:Cl、C、Si | C.进行酸碱中和滴定实验 | D.测定中和热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑥ | C. | ②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
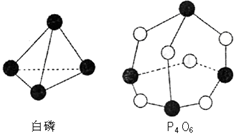 化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )
化学反应可视为旧健断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)出的能量.已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(kJ•mol-1)P-P:198;P-O:360;O-O:498.则反应P4(白磷)+3O2=P4O6的反应热△H为( )| A. | -1638kJ/mol | B. | +1638kJ/mol | C. | -126kJ/mol | D. | +126kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉代替铁钉与稀硫酸反应制取氢气 | |
| B. | 双氧水制氧气时加入少量二氧化锰 | |
| C. | 镁和水反应时,适当进行加热 | |
| D. | 食品放在冰箱中贮藏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
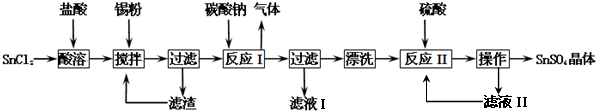
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com