
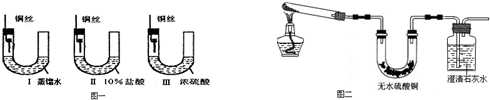


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:

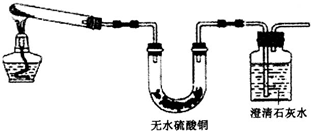

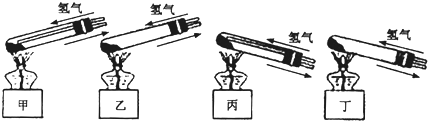
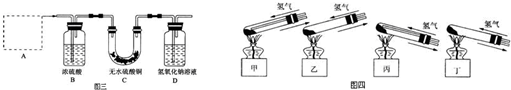
查看答案和解析>>
科目:高中化学 来源: 题型:
A.铜锌原电池中铜为负极?
B.0.1 mol N2与0.1 mol H2在一定条件下反应达到平衡时,生成0.2 mol氨?
C.1 mol·L-1 AlCl3溶液中,铝离子物质的量浓度为1 mol·L-1?
D
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省孝感高级中学高二上学期期末考试化学试卷(带解析) 题型:填空题
(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且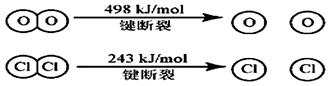
则断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差为__________KJ。
(2)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

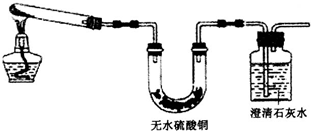

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com