下列说法正确的是
A.乙烯、苯均能使酸性高锰酸钾溶液褪色 B.乙醇和乙醛均能发生氧化反应生成乙酸
C.油脂水解的产物是氨基酸和甘油 D.淀粉和聚乙烯都是天然髙分子化合物
练习册系列答案
相关习题
科目:高中化学
来源:
题型:阅读理解
二甲醚(CH
3OCH
3)被称为21世纪的新型能源,是一种高效、清洁能源.
Ⅰ.工业制备二甲醚的生产流程如下:

催化反应室中(压力2.0~10.0Mpa,温度230~280℃)发生如下反应:
①CO(g)+2H
2(g)?CH
3OH(g)△H=-90.7kJ/mol
②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H=-23.5kJ/mol
③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H=-41.2kJ/mol
(1)二甲醚也可以通过天然气和CO
2合成制得,该反应的化学方程式为
3CH4+CO2→2CH3OCH3
3CH4+CO2→2CH3OCH3
.
(2)催化反应室中总反应3CO(g)+3H
2(g)?CH
3OCH
3(g)+CO
2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
,830℃时反应③的K=1.0,则在催化反应室中反应③的K
>
>
1.0(填“>”、“<”或“=”).
(3)在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒压,发生反应②,测得反应达到平衡时的有关数据如下.
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol CH3OCH3、1mol H2O |
2mol CH3OH |
1mol CH3OH |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
吸收a kJ |
放出b kJ |
放出c kJ |
| 平衡时体积(L) |
V1 |
V2 |
V3 |
| 反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是
A、B、C
A、B、C
.(填字母序号)
A.a+2c=23.5 B.α
1+α
2=1 C.V
1>V
3 D.c
1=2c
3(4)上述生产流程中,可以循环使用的物质有
甲醇和水、CO和H2
甲醇和水、CO和H2
.
Ⅱ.用二甲醚-空气碱性(KOH)燃料电池作电源电解精炼粗铜(如图),在接通电路一段时间纯Cu质量增加3.2g.

(5)请写出燃料电池中的负极反应式:
CH3OCH3-12e-+16OH-=2CO32-+11H2O
CH3OCH3-12e-+16OH-=2CO32-+11H2O
.
(6)燃料电池正极消耗标准状况下空气的体积是
2.8L
2.8L
(空气中O
2体积分数以20%计算).
查看答案和解析>>
科目:高中化学
来源:
题型:
意大利科学家最近研制出一种新型的氧分子,其化学式为O4,下列说法正确的是A.一个O4分子由2个O2分子构成( )
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解

非金属元素氮有多种氧化物,如NO、NO
2、N
2O
4等.
(1)对反应N
2O
4(g)?2NO
2(g),△H=+57kJ?mol
-1在温度为T
1、T
2时,平衡体系中NO
2的体积分数随压强变化曲线如图所示.
下列说法正确的是
a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
(2)在100℃时,将0.400mol的NO
2气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为
.
②已知100℃反应2NO
2?N
2O
4的平衡常数K=2.8.若该温度下某时刻测得c(NO
2)=1.00mol/L,c(N
2O
4)=0.20mol/L,则该时刻的v
正
v
逆(填“>”、“<”或“=”);升高温度后,平衡常数K将
(填“增大”、“减小”或“不变”).
③若在相同情况下最初向该容器只充入的是N
2O
4气体,要达到上述同样的平衡状态,N
2O
4的起始浓度是
mol?L
-1.
④计算在题③的条件下达到平衡后混合气体的平均相对分子质量为
.(结果保留小数点后一位)
(3)肼(N
2H
4)通常是航天航空的重要燃料,我们常用的一种肼燃料电池,是以肼与氧气的反应为原理设计的(N
2H
4+O
2=N
2+2H
2O),其电解质溶液是KOH溶液.写出该电池负极的电极反应式
.
查看答案和解析>>
科目:高中化学
来源:
题型:
(1)Cl
2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl
2是否泄漏,有关反应的化学方程式为3Cl
2(气)+8NH
3(气)=6NH
4Cl(固)+N
2(气).若反应中消耗Cl
2 1.5mol,则被氧化的NH
3在标准状况下的体积为
L.
(2)ClO
2是一种消毒杀菌效率高、污染小的水处理剂,它在食品保鲜方面也有广泛应用.
①实验室制备ClO
2的方法之一为:2KClO
3+H
2C
2O
4+H
2SO
42ClO
2↑+K
2SO
4+2CO
2↑+2H
2O(H
2C
2O
4俗称草酸,其中H为+1价、O为-2价),则下列说法正确的是
A.KClO
3在反应中得到电子B.ClO
2是氧化产物
C.H
2C
2O
4在反应中被氧化D.1molKClO
3参加反应有2mol电子转移
②KClO
3和浓盐酸在一定温度下反应也会生成绿黄色的二氧化氯.其变化可表示为:2KClO
3+4HCl=2KCl+2ClO
2↑+Cl
2↑+2H
2O已知每产生0.1molCl
2,则发生转移的电子的物质的量为0.2mol.ClO
2具有很强的氧化性,因此常被用作消毒剂,其消毒后的还原产物是氯离子,则其消毒的效率(以单位质量得到的电子数表示)是Cl
2的
倍.
查看答案和解析>>
科目:高中化学
来源:
题型:阅读理解
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法研究反应速率的有关问题.
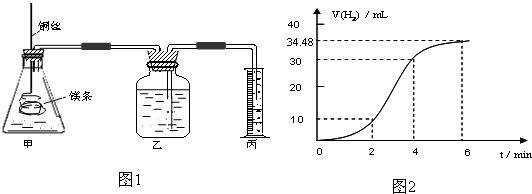
(1)实验1 探究Mg与盐酸反应速率的变化规律.取一段镁条,用砂纸擦去表面的氧化膜,铜丝缠着镁条伸入装置甲中,使镁条浸入锥形瓶内的体积为2L稀盐酸(足量)中.镁条和盐酸反应生成H
2的体积与反应时间的关系曲线如图2所示.
①从图2中看出0-6min内平均反应速率最快的时间段是
.(填代号)
A.0-2min B.2-4min C.4-6min
②请计算4-6min 时间内,用HCl表示的平均反应速率为
.(假设图2氢气体积均已换算为标准状况下的体积,且溶液体积变化可忽略)
③图1装置甲中与镁条相连的铜丝若一起浸入稀盐酸中对反应速率影响下列说法正确的是
A.加快反应速率但生成氢气的总量不变 B.减慢反应但增大生成氢气总量
C.不影响反应速率 D.加快反应速率但生成氢气的总量减小
(2)实验2 探究酸浓度对MnO
2与H
2O
2反应速率的影响
已知MnO
2+H
2O
2+2H
+═Mn
2++O
2↑+2H
2O,现取等量MnO
2和下表有关物质,在相同温度下进行4组实验,分别记录收集20.0mL氧气所需时间.
| 实验编号 |
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
| 10%H2O2的体积/mL |
5.0 |
5.0 |
V1 |
V2 |
| 20%硫酸的体积/mL |
0 |
0.5 |
1.0 |
V3 |
| 水的体积/mL |
15 |
14.5 |
V4 |
13.5 |
| 所需时间t/s |
t1 |
t2 |
t3 |
t4 |
①上表中V
1=
mL,V
3=
mL.
②有同学提出实验I不可作为实验Ⅱ、Ⅲ、Ⅳ的对比实验,其理由是
.
③若实验测得t
2>t
3>t
4,则可得出的实验结论是
.
查看答案和解析>>



 非金属元素氮有多种氧化物,如NO、NO2、N2O4等.
非金属元素氮有多种氧化物,如NO、NO2、N2O4等.