
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ҺpH��NaF��NaCN | B��n1 �� n2 | C��n1�� n2 | D��c(F��)��c(CN��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��Na2CO3��NaHCO3���������������ʳ���� |
| B��NaHSO4��Һ������ |
| C�����ο�������ˮ�� |
| D��TiCl4��Һ�����ɡ������Ƶ�TiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��pH �� 7����c(OH��) �� c(Na��) ��c(H��) ��c(CH3COO��) |
| B��pH �� 7����c(Na��) + c(H��) = c(OH��) + c(CH3COO��) |
| C��pH �� 7����c(CH3COO��) ��c(H+) �� c(Na+) �� c(OH��) |
| D��pH �� 7����c(CH3COO��) = c(Na+) �� c(H+) = c(OH��) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
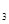 ��Һʱ��������FeCl
��Һʱ��������FeCl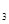 ��Һ�м������������
��Һ�м������������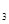 ��A1
��A1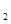 (SO
(SO )
)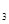 ������Һ������ĭ������
������Һ������ĭ������ Cl��Һ�м������þ�����������
Cl��Һ�м������þ�����������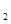 CO
CO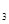 ��Һ���Լ�ƿӦ����Ƥ����
��Һ���Լ�ƿӦ����Ƥ����| A���٢ۢ� | B���ڢۢ� | C���ۢܢ� | D��ȫ���й� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ڳ����£�Na2SiO3+H2O+CO2 = Na2CO3+H2SiO3����˵��H2CO3����ǿ��H2SiO3�� �ڸ����£� 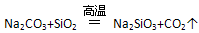 ��˵��H2SiO3����ǿ��H2CO3 ��˵��H2SiO3����ǿ��H2CO3 |
| B��c��NH4+����ȵģ�NH4��2SO4����NH4��2CO3����NH4��2Fe��SO4��2��Һ���� c[��NH4��2SO4]��c[��NH4��2CO3] ��c[��NH4��2Fe��SO4��2] |
| C����1L0.3mol/L��NaOH��Һ�л���ͨ��CO2��������Һ����8.8gʱ������Һ�� 2c��Na+��=3[c��HCO3-��+c��CO32-��+c��H2CO3��] |
| D���ں�������ȡ���ʵ���мȿ��������Ȼ�̼����ȡ��Ҳ�����þƾ�����ȡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com