
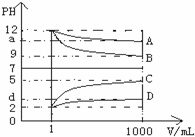
分析 (1)根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸;
(2)氨水与盐酸反应生成氯化铵;
(3)B是氢氧化钠,D是醋酸,等物质的量反应生成醋酸钠,加热促进醋酸根离子的水解.
解答 解:(1)根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸,
故答案为:NaOH;HCl;
(2)氨水与盐酸反应生成氯化铵,反应离子方程式为:NH3•H2O+H +=H2O+NH4+,故答案为:NH3•H2O+H +=H2O+NH4+;
(3)B是氢氧化钠,D是醋酸,等物质的量反应生成醋酸钠,醋酸钠在溶液中水解溶液显碱性,加热促进醋酸根离子的水解,溶液的碱性增强,溶液的pH增大;
故答案为:碱;增大.
点评 本题考查了物质的推断、弱电解质的电离、离子浓度比较、酸碱混合溶液定性判断、pH计算等,关键是明确弱电解质的电离特点推断物质,题目难度中等.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:解答题
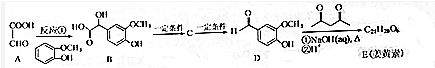
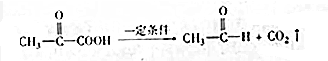


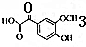
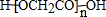
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
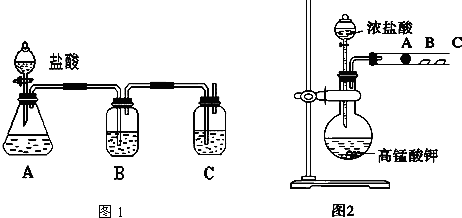
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,将氨水稀释,NH3?H2O 的电离度增大,H2O 的电离度也增大 | |
| B. | 水中加酸加碱都会阻碍水的电离,所以 c(H+)?c(OH-)<10-14 | |
| C. | 水中加酸,阻碍水的电离,所以 c(H+)=c(OH-)<10-7 mol•L-1 | |
| D. | 醋酸溶液加水稀释,溶液中所有微粒的浓度都会降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | a mol•L-1 HCN溶液与b mol•L-1 NaOH溶液等体积混合后,若所得溶液中c(Na+)>c(CN-),则a可能大于b | |
| C. | 冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度均先增大后减小 | |
| D. | NaHCO3溶液中,一定存在c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
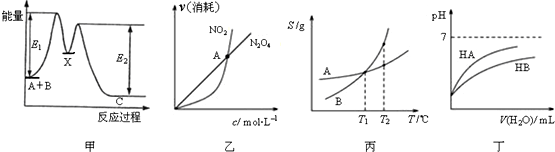
| A. | 由甲可知:加入催化剂可改变反应A+B→C的焓变 | |
| B. | 由乙可知:对于恒温恒容条件下的反应2NO2(g)?N2O4(g),A点为平衡状态 | |
| C. | 由丙可知:将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A | |
| D. | 由丁可知:相同温度、相同浓度的HA溶液与HB溶液相比,其pH前者小于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A是强酸、B一定是弱酸 | B. | A是弱酸、B一定是强酸 | ||
| C. | A是强酸、B是强酸 | D. | A酸性一定比B酸性弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.2 g | B. | 8.8 g | C. | 8.0 g | D. | 11.2 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com