
同一主族的两种元素的原子序数之差不可能是( )
A.16 B.26 C.36 D.46
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源:2014年化学高考总复习单元检测 第十、十一章有机、实验练习卷(解析版) 题型:选择题
下列装置或操作不能达到实验目的的是( )


A.利用甲装置检查装置的气密性
B.利用乙装置制取NO2,并检验其还原性,小试管中的试剂可为淀粉KI溶液
C.利用丙装置制取并收集氨气
D.利用丁装置分离沸点相差较大的液体混合物
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第八章水溶液中的离子平衡练习卷(解析版) 题型:选择题
常温下,向0.1 mol/L的H2SO4溶液中逐滴加入0.1 mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是
( )

A.a~d溶液的pH:a<b<c<d
B.a~d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c (OH-)相等
D.c处溶液和d处溶液均呈碱性
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第五章物质结构、元素周期律练习卷(解析版) 题型:填空题
X、Y、Z、W为四种短周期元素。X原子最外层电子数是核外电子层数的3倍;Y最高正价与最低负价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+3。回答下列问题:
(1)Y-的结构示意图为 。
(2)写出含有10个中子的X原子的原子符号 。
(3)Z的最高价氧化物与Z同主族的单质A能发生置换反应,这个反应在工业上是获得Z的一步重要反应。写出该步反应的化学方程式,并用单线桥法标出电子转移的方向与数目 。
(4)向WY3溶液中加入足量的NaOH溶液,反应的离子方程式为 。
(5)Y的气态氢化物与氨气在空气中相遇有白烟生成,该反应的化学方程式为 。
(6)ZX2中存在的化学键为 (填“离子键”或“共价键”),ZX2与NaOH溶液反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第五章物质结构、元素周期律练习卷(解析版) 题型:选择题
下列有关化学用语的表述正确的是( )
A.原子核内有8个中子的碳原子148C
B.钠离子的结构示意图
C.H2O的电子式:
D.乙醇的分子式:C2H6O
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第二章化学物质及其变化练习卷(解析版) 题型:填空题
1 L 某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、 |
可能大量含有的阴离子 | Cl-、Br-、I-、 |
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是________________。

(2)BC段的离子方程式为__________________________。
(3)V1、V2与V3、V4之间的关系为____________________。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题:
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8 L时,溶液中发生反应的离子方程式为____________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为_________________。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第二章化学物质及其变化练习卷(解析版) 题型:选择题
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.Cu2S既是氧化产物又是还原产物
B.5 mol FeS2发生反应时有10 mol电子转移
C.产物中的 有一部分是氧化产物
有一部分是氧化产物
D.FeS2只作还原剂
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习单元检测 第九章电化学基础练习卷(解析版) 题型:填空题
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8 kJ/mol、282.5 kJ/mol、726.7 kJ/mol。请回答:
(1)已知CO和H2在一定条件下可以合成甲醇:CO+2H2=CH3OH。则H2与CO反应生成CH3OH的热化学方程式为: 。
(2)如图为某种燃料电池的工作原理示意图,a、b均为惰性电极。

①使用时,空气从 口通入(填“A”或“B”);
②假设使用的“燃料”是甲醇,a极的电极反应式为: ________________
③假设使用的“燃料”是水煤气(成分为CO、H2)用这种电池电镀铜,待镀金属增重6.4 g,则至少消耗标准状况下水煤气的体积为 。
查看答案和解析>>
科目:高中化学 来源:2014年化学高考复习演练4-5海水资源利用环境保护绿色化学练习卷(解析版) 题型:实验题
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
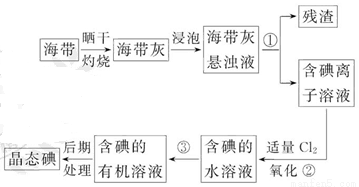
(1)步骤①的实验操作名称是_________;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品。完成该实验尚缺少的玻璃仪器是_________;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是_________;
A.CCl4与水不互溶
B.CCl4可与I2发生取代反应
C.CCl4的密度比水大
D.CCl4不易燃烧,可作灭火剂
E.碘在CCl4中的溶解度比在水中大很多
(4)步骤③中还可选择_________作萃取剂;
(5)步骤②中反应的离子方程式是__________________________________;
(6)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com