
【题目】25℃时,向20 mL 0.1 mol/L一元弱酸HA溶液中滴加0.1 mol/L NaOH溶液,溶液中lg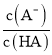 与pH关系如图所示。下列说法正确的是
与pH关系如图所示。下列说法正确的是
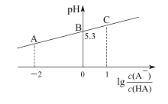
A.A点或B点所示溶液中,离子浓度最大的均是Na+
B.HA滴定NaOH溶液时可用甲基橙作指示剂
C.达到图中B点溶液时,加入NaOH溶液的体积小于10 mL
D.对C点溶液加热(不考虑挥发),则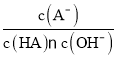 一定增大
一定增大
【答案】C
【解析】
A. 溶液在A、B点时,溶液显酸性,则c(H+)>c(OH-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+c(A-),由于c(H+)>c(OH-),所以c(Na+)<c(A-),故A、B点溶液中离子浓度最大的都不是Na+,A错误;
B. HA为弱酸,NaOH为强碱,HA与NaOH恰好完全反应时生成强碱弱酸盐NaA,由于A-的水解NaA溶液呈碱性,而甲基橙作指示剂时溶液pH变化范围是3.1~4.4,所以HA滴定NaOH溶液时不能选择甲基橙作指示剂,B错误;
C. 溶液在B点时pH=5.3,lg =0,则c(A-)=c(HA),弱酸HA的电离平衡常数Ka=
=0,则c(A-)=c(HA),弱酸HA的电离平衡常数Ka=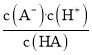 =c(H+)=10-5.3,A-的水解平衡常数Kh=
=c(H+)=10-5.3,A-的水解平衡常数Kh=![]() <10-5.3,若向20 mL0.1mol/L HA溶液中加入10 mL0.1mol/LNaOH溶液,得到的是等浓度的HA、NaA的混合溶液,由于HA的电离程度大于NaA的水解程度,则溶液中c(A-)>c(HA),即lg
<10-5.3,若向20 mL0.1mol/L HA溶液中加入10 mL0.1mol/LNaOH溶液,得到的是等浓度的HA、NaA的混合溶液,由于HA的电离程度大于NaA的水解程度,则溶液中c(A-)>c(HA),即lg >0,故B点溶液时,加入NaOH溶液的体积小于10 mL,C正确;
>0,故B点溶液时,加入NaOH溶液的体积小于10 mL,C正确;
D. 温度升高,盐水解程度增大,A-的水解平衡常数会增大,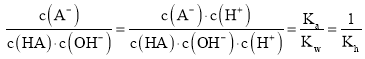 会随温度的升高而减小,D错误;
会随温度的升高而减小,D错误;
故答案选C。


科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法,不正确的是
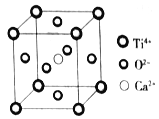
(Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)
A. 该晶体的化学式为CaTiO3
B. 该晶体中每个Ti4+和8个O2-相紧邻
C. 一个CO2晶胞中平均含有4个CO2分子
D. 金属晶体的熔点可能比分子晶体的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究元素周期表中元素性质的递变规律,设计了如下实验。
Ⅰ.(1)将外观相近的钠、钾、镁、铝各1克分别投入到足量的同浓度的盐酸中,试预测实验结果:__与盐酸反应最剧烈,___与盐酸反应的速度最慢;__与盐酸反应产生的气体最多。
(2)向H2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为_______
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
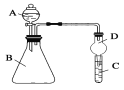
(3)仪器A的名称为________
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液_____(填现象),即可证明
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液观察到C中_______(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰试验,应在两装置间添加装有_______溶液的洗气瓶除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项中,为完成相应实验,所用仪器或相关操作合理的是( )
A | B | C | D |
配制1mol/L AlCl3溶液 | 实验室制取 氢气 | 比较硫、碳、硅三种 元素的非金属性强弱 | 盛装NaOH 溶液 |
|
|
|
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是( )
A. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
B. 32 g S8(分子结构:![]() )中的共价键数目为NA
)中的共价键数目为NA
C. 标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
D. 39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是

A. ①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液
B. 管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
C. 结束反应时,先关闭活塞K,再停止加热
D. 装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用镁屑与液溴为原料制备无水MgBr2, 装置如图, 主要步骤如下:

步骤1组装好仪器,向三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2 。
步骤3反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4室温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁, 加热至160℃分解得无水Mg Br2产品。
已知:①Mg和Br2反应剧烈放热;Mg Br2具有强吸水性。
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5
③乙醚是重要有机溶剂,医用麻醉剂;易挥发储存于阴凉、通风处;易燃远离火源。
请回答下列问题:
(1)写出步骤2的操作是_________。
(2)仪器A的名称是__________。装置中碱石灰的作用__________。冰水浴的目的__________。
(3)该实验从安全角度考虑除了控制反应温度外,还需要注意:
①_________②_______。
(4)制备MgBr2装置中橡胶塞和用乳胶管连接的玻璃管口都要用锡箔纸包住的目的是_________。
(5)有关步骤4的说法,正确的是__________。
A 可用95%的乙醇代替苯溶解粗品 B 洗涤晶体可选用0℃的苯
C 加热至160℃的主要目的是除去苯 D 该步骤的目的是除去乙醚和可能残留的溴
(6)为测定产品的纯度,可用EDTA(简写为Y4-) 标准溶液滴定,反应的离子方程式:Mg2+ +Y4-═MgY2-
①先称取0.7500g无水MgBr2产品,溶解后,等体积分装在3只锥形瓶中, 用0.0500mol·L-1的EDTA标准溶液滴定至终点,三次消耗EDTA标准溶液的体积平均为26.50mL, 则测得无水MgBr2产品的纯度是_______(保留4位有效数字)。
②滴定前未用标准溶液润洗滴定管,则测得产品纯度___________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是
A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
D. x、y、z中只有x的所有原子可能处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com