
【题目】下列过程中化学键没有被破坏的是
A. 水降温结冰 B. 水电解得到氧气与氢气
C. 金刚石加热融化 D. NaOH溶于水
科目:高中化学 来源: 题型:
【题目】下列关于2mol二氧化碳的叙述中,正确的是
A.质量为88g/molB.含有2mol原子
C.分子数为6.02×1023个D.标准状况下的体积为44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) 2Z(g),ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是。
A. 反应前2 min的平均速率v(Z)=2.0×10-3mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.3 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 用高锰酸钾标准溶液滴定草酸:2MnO4-+16H++5C2O42-===2Mn2++10CO2↑+8H2O
B. Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 惰性电极电解MgCl2溶液:2Cl+2H2O![]() Cl2↑+2OH-+ H2↑
Cl2↑+2OH-+ H2↑
D. 向NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2++OH- ===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
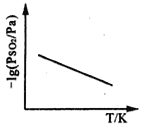
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 化学键的断裂和形成是化学反应中能量变化的根本原因
B. 酸碱中和反应一般是放热反应
C. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D. 因为石墨变成金刚石吸热。所以金刚石比石墨稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com