
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
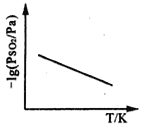
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
【答案】-203.5 kJmol-1 0.36 37.5% 减小 温度升高时,-lg(![]() )减小,则
)减小,则![]() 增大,化学平衡向逆向移动,化学平衡常数减小 H+与Fe粉反应生成H2 Fe与置换出的Cu构成原电池,加快NO3-的去除速率 3.84×10-5 C D
增大,化学平衡向逆向移动,化学平衡常数减小 H+与Fe粉反应生成H2 Fe与置换出的Cu构成原电池,加快NO3-的去除速率 3.84×10-5 C D
【解析】
(1)根据目标反应方程式,①×2+2×②-③,△H=(-41.0×2-49.0×2-23.5)kJ·mol-1=-203.5kJ·mol-1;(2)①根据化学平衡常数的定义,K3=![]() ,K1=
,K1= ,K2=
,K2= ,K3=K1×K2=0.018×20=0.36;②
,K3=K1×K2=0.018×20=0.36;②
SO2(g)+NO2(g)SO3(g)+NO(g)
起始: 0.2 0.2 0 0
变化: x x x x
平衡: 0.2-x 0.2-x x x 根据化学平衡常数的表达式,求出x=0.075mol,则SO2的转化率为0.075/0.2×100%=37.5%;③根据坐标系,温度升高时,-lg(PSO2)减小,则PSO2增大,化学平衡向逆向移动,化学平衡常数减小;(3)①pH偏低,c(H+)增大,Fe能与H+反应生成H2,造成与NO3-反应Fe的量减少,使NO3-的去除率降低;②II中加入少量的Cu2+,Fe能把Cu2+置换出来,构成原电池,加快反应速率,从而加快NO3-去除率;0~20min消耗NO3-的物质的量浓度为(8×10-4-0.32×10-4)mol·L-1=7.68×10-4mol·L-1,根据化学反应速率数学表达式,v(NO3-)=7.68×10-4/20mol/(L·min)=3.84×10-5mol/(L·min);(4)A、根据电荷守恒,因此有c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),故A说法正确;B、根据物料守恒,c(Na+)=c(HSO3-)+c(SO32-)+c(H2SO3),故B说法正确;C、HSO3-的水解平衡常数为Kh=Kw/Ka1=![]() ≈7×10-13<Ka1,HSO3-的电离程度大于水解程度,溶液显酸性,即离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故C说法错误;D、根据质子守恒,c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故D说法错误;综上所述CD符合题意。
≈7×10-13<Ka1,HSO3-的电离程度大于水解程度,溶液显酸性,即离子浓度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),故C说法错误;D、根据质子守恒,c(H2SO3)+c(H+)=c(SO32-)+c(OH-),故D说法错误;综上所述CD符合题意。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】下列关于实验操作的叙述不正确的是
A.蒸馏时,在烧瓶中加几粒沸石
B.加液时,胶头滴管悬置在试管正上方
C.萃取时,分液漏斗正立振荡后,直接放在铁架台上,静置
D.分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯费塑料可以得到碳、氢气、甲烷、乙烯、苯和甲苯,用图所示装置探究废旧塑料的再利用,下列叙述不正确的是( )
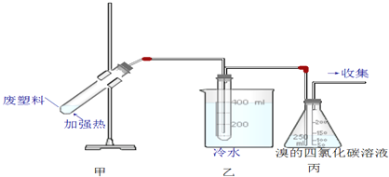
A. 装置乙的试管中可收集到芳香烃
B. 装置丙中的试剂可吸收烯烃以制取卤代烃
C. 最后收集的气体可做燃料
D. 聚丙烯的链节是﹣CH2﹣CH2﹣CH2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们日常生活中的吃、穿、住、行、医关系密切:
(1)油脂、淀粉、蛋白质是我们食物中提供能量的主要物质,在人体内都能发生水解。
①油脂在酸性条件下水解的最终产物是_________和_________;
②上述三种物质不属高分子化合物的是_________,若要检验淀粉在淀粉酶作用下已经发生了水解,可取少量水解实验的溶液加入_________(填试剂的名称),加热后再根据实验现象判断;若要检验淀粉没有完全水解的,可取少量水解溶液加入几滴________,应观察到出现蓝色;
③蛋白质在人体内水解的最终产物是氨基酸.写出氨基酸共同含有的官能团的结构简式分别为_________和﹣COOH;
(2)现在越来越多的自行车采用铝合金作材料,它不仅轻便美观,而且也很耐久.它能长期使用的原因是_________,橡胶是制造轮胎的重要原料,天然橡胶通过硫化措施使其分子转变为_________分子结构可增大强度和弹性;
(3)聚丙烯腈﹣合成腈纶又称人造羊毛,丙烯腈为CH2=CHCN,请写出聚丙烯腈的结构简式_________,生活中除常用的氯系消毒剂外,过氧乙酸是另一种常见消毒剂,主要是因为其结构中含有_________而表现出强氧化性;
(4)_________形成的合金被称为“亲生物金属”,广泛作为人造骨的材料.为防止工业生产过程产生的悬浮颗粒物进入大气,可以将混有悬浮颗粒物的气体通过沉降进行处理;
(5)居室装修所用的有些石材会释放出一种放射性物质,长期接触可能引起癌症,免疫功能异常,该放射性物质主要是_________(填写该物质的名称);
(6)氢氧化铝、碳酸镁都可用于治疗胃酸过多引起的不适,请分别写出相关反应的离子方程式:①_________②_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
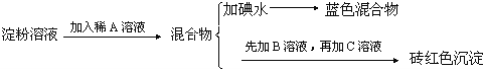
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国部分城市灰霾天占全年一半,引起灰霾的 PM2.5 微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等。通过测定灰霾中锌等重金属的含量,可知目前造成我国灰霾天气的原因主要是交通污染。
(1)Zn2+在基态时核外电子排布式为_____。
(2)NO3-的立体构型是_____。
(3)PM2.5 含有大量的有毒、有害物质,易引发二次光化学烟雾污染,光化学烟雾中含有 NOx、O3、CH2=CH—CHO、HCOOH、CH3COOONO2(PAN)等二次污染物。
①下列说法正确的是_____。
A.N2O 结构式可表示为 N=N=O
B.O3 分子呈直线形
C.CH2=CH—CHO 分子中碳原子均采用 sp2 杂化
D.相同压强下,HCOOH 沸点比 CH3OCH3高,说明前者是极性分子,后者是非极性分子
②1 mol PAN 中含σ键数目为_____(用含 NA的式子表示)。
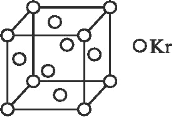
③NO 能被 FeSO4 溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为_____(填数字)。
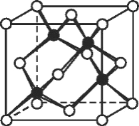
(4)测定大气中 PM2.5 的浓度方法之一是β-射线吸收法,β-射线放射源可用 85Kr,已知 Kr晶体的晶胞结构如图所示,设晶体中与每个 Kr 原子相紧邻的 Kr 原子有 m 个,晶胞中含 Kr
原子为 n 个,则m/n=___(填数字)。
(5)水分子的立体结构是_____,水分子能与很多金属离子形成配合物,其原因是在氧原子上有__________。
(6)冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,其中空心所示原子位于立方体的 顶点或面心,实心球所示原子位于立方体内)类似。每个冰晶胞平均占有_____个水分子。 冰晶胞与金刚石晶胞微粒排列方式相同的原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按纯净物、混合物、电解质顺序排列的一组物质是( )
A.盐酸、空气、醋酸B.液氯、海水、硫酸钠晶体
C.铁粉、碘盐、氨水D.胆矾、漂白粉、氯化钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com