
【题目】某同学称取9.00g淀粉溶于水,测定淀粉的水解百分率.其程序如下:
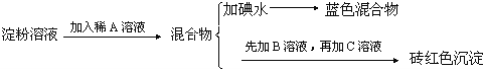
试回答下列问题:
(1)各步加入的试剂为:A_________,B_________,C_________;
(2)加入A溶液而不加入B溶液是否可以_________,其理由是_________;
(3)写出淀粉水解的方程式_________;
(4)当析出1.44g砖红色沉淀时,淀粉水解率是_________;[已知葡萄糖与Cu(OH)2反应的化学方程式为:CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
CH2OH(CHOH)4COOH+Cu2O↓+2H2O]。
【答案】 H2SO4 NaOH Cu(OH)2悬浊液 不可以 葡萄糖与氢氧化铜的反应必须在碱性条件下才能进行 (C6H10O5)n+n H2O![]() n C6H12O6 18%
n C6H12O6 18%
【解析】分析:淀粉在酸性条件下水解生成葡萄糖,加碱中和之后溶液呈碱性,然后加入新制的氢氧化铜悬浊液,有砖红色沉淀生成,此法可检验淀粉水解的产物葡萄糖;淀粉遇碘单质变蓝;
葡萄糖与新制氢氧化铜反应应该在碱性环境下进行;
依据(C6H10O5)n~nC6H12O6~nCu2O,根据生成的Cu2O的质量求出水解的淀粉的质量,淀粉的水解率=![]() ×100%。
×100%。
(1)淀粉在稀硫酸作用下水解生成葡萄糖,加Na0H溶液中和稀硫酸,使混合液呈碱性;向混合液中加入新制氢氧化铜悬浊液,加热至沸腾生成红色沉淀,证明淀粉已水解,水解后的溶液加碘水变蓝,则说明水解不完全;因此,本题答案为:H2SO4 ;NaOH; Cu(OH)2悬浊液;
(2)葡萄糖与新制Cu(OH)2悬浊液反应应该在碱性环境下进行,加Na0H溶液的作用是中和稀硫酸,使混合液呈碱性,若不加氢氧化钠溶液,此时的酸性环境破坏了新制Cu(OH)2悬浊液,所以不可以不加入B溶液,因此,本题答案为:不可以;葡萄糖与氢氧化铜的反应必须在碱性条件下才能进行;
(3)淀粉水解的方程式为:(C6H10O5)n(淀粉)+nH2O![]() nC6H12O6(葡萄糖);
nC6H12O6(葡萄糖);
(4)一元醛与新制氢氧化铜反应的方程式为:
CH2OH(CHOH)4CHO+2Cu(OH)2![]() CH2OH(CHOH)4COOH+2H2O+Cu2O↓,
CH2OH(CHOH)4COOH+2H2O+Cu2O↓,
设水解的淀粉的质量为x。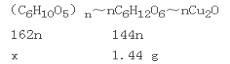
x=![]() =1.62g;
=1.62g;
淀粉的水解率=![]() ×100%=
×100%=![]() ×100%=18%。
×100%=18%。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲推测某气体为CO2和SO2的混合气体,设计如下装置图,已知:气体从a端通入,回答问题。
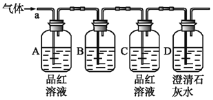
(1)B中试剂为_________(填序号)。
①氯化钠溶液 ②酸性高锰酸钾溶液 ③盐酸 ④澄清石灰水
(2)A中品红溶液的作用是___________________。
(3)D中澄清石灰水的作用是_______________。
(4)若该气体确实为CO2和SO2的混合气体,则A、C、D中的现象分别为:
________________________、________________________、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外活动小组拟用铅蓄电池进行电絮凝净水的实验探究,设计的实验装置如图所示,下列叙述正确的是( )

A. Y 的电极反应: Pb-2e- = Pb2+
B. 铅蓄电池工作时SO42-向 Y 极移动
C. 电解池的反应仅有2Al+6H2O![]() 2Al(OH)3+3H2↑
2Al(OH)3+3H2↑
D. 每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“废气”的综合处理与应用技术是科研人员的重要研究课题,CO、SO2、NO2是重要的大气污染气体。
(1)处理后的CO是制取新型能源二甲醚(CH3OCH3)的原料。
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1= -41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2= -49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3= +23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=________.
(2)已知973 K时,SO2与NO2反应生成SO3和NO,将混合气体经冷凝分离出的SO3可用于制备硫酸。
①973 K时,测得:NO2(g) NO(g)+ ![]() O2(g) K1=0.018;SO2(g) +
O2(g) K1=0.018;SO2(g) + ![]() O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
O2(g) SO3(g) K2=20;则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=________
②973K时,向容积为2 L的密闭容器中充入SO2、NO2 各0.2mol。平衡时SO2的转化率为______。
③恒压下,SO2的分压PSO2随温度的变化如图所示:
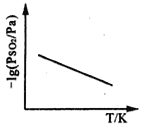
当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数______(填“增大”或“减小”), 判断理由是______________________。
(3)用纳米铁可去除污水中的NO3-。
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是______________________。
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。下表中Ⅰ和Ⅱ产生差异的原因可能是________________________________________;Ⅱ中0~20min,用NO3-表示的平均反应速率为______________mol·L-l·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol·L-1 | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol·L-1 (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
(4)用NaOH溶液吸收SO2可得NaHSO3溶液,对NaHSO3溶液中各离子浓度的关系,下列分析不合理的是___。(已知常温下K1(H2SO3)=1.5×10-2,,K2(H2SO3)=1.02×10-7)
A.c(Na+)+c(H+)=c(HSO3-) +2c(SO32-) +c(OH-)
B.c(Na+) =c(HSO3-) +c(SO32-) +c(H2SO3)
C.c(Na+) >c(SO32-) >c(HSO3-) > (OH-)c>c(H+)
D.c(H+) +c(SO32-) =c(OH-) +c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是
A. 不能使酚酞试液变红的无色溶液中:Na+、CO![]() 、K+、ClO-、AlO
、K+、ClO-、AlO![]()
B. 常温下水电离出的c(H+)·c(OH-)=10-20的溶液中:Na+、Cl-、S2-、SO![]()
C. 能与金属铝反应放出氢气的溶液中: K+、NO![]() 、Cl-、NH
、Cl-、NH![]()
D. 含有HCO![]() 的溶液中:K+、OH-、NO
的溶液中:K+、OH-、NO![]() 、Ca2+
、Ca2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
A. 化学键的断裂和形成是化学反应中能量变化的根本原因
B. 酸碱中和反应一般是放热反应
C. 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量多
D. 因为石墨变成金刚石吸热。所以金刚石比石墨稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00 mL,分离并测定Fe3+的浓度,实验方案设计如下:
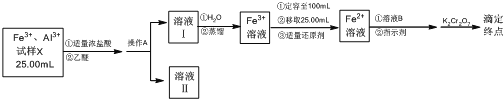
已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5 ℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
请回答:
(1)操作A的名称是____________。
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案___________。
(3)滴定前,加入的适量溶液B是________。
A.H2SO3H3PO4 B.H2SO4H3PO4 C.HNO3H3PO4 D.HIH3PO4
(4)滴定达到终点时,消耗0.100 0 mol·L-1 K2Cr2O7溶液6.00 mL。根据该实验数据,试样X中c(Fe3+)为________。
(5)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是________。
A.稀释被测试样 B.减少被测试样取量
C.增加平行测定次数 D.降低滴定剂浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(CN)2、(OCN)2等被称为拟卤素,(CN)2在一定条件下氢化可以得到乙二胺(H2NCH2CH2NH2)。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。写出外界离子基态核外电子排布式:________________。
(2)与OCN-互为等电子体的分子为________(填分子式)。
(3)1 mol(CN)2中含有π键的数目为________。
(4)乙二胺中C原子的轨道杂化方式为________。
(5)乙二胺易溶于水,除因为是极性分子外,还可能的原因为________。
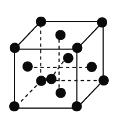
(6)含CN-的配合物常用于冶炼黄金。金的晶胞结构如下图所示,晶体中每个Au原子周围紧邻且等距的Au原子有________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com