
 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A、质量增加6.4g |
| B、质量增加12.8g |
| C、质量减少6.4g |
| D、质量减少12.8g |
| 2.24L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、在Fe2(SO4)3溶液中可以大量存在:K+、Fe2+、Cl-、Br-、SCN- | ||
| B、c(H+)=1×10-13mol/L的溶液中可以大量存在:Mg2+、Cu2+、HCO3-、NO3- | ||
C、加水稀释时
| ||
| D、在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定形成共价键 |
| B、一定形成离子键 |
| C、可能形成共价键,也可能形成离子键 |
| D、以上说法都不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,11.2 LCO2所含的原子数为1.5NA | ||
| B、常温常压下,48 g O3含有的氧原子数为3NA | ||
| C、标准状况下,22.4 L SO3中所含原子数为4NA | ||
D、标准状况下,1 L水所含分子数为
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每种元素的原子都可以写出电子式 |
| B、简单阳离子的电子式与它的离子符号相同 |
| C、阴离子的电子式要加方括号表示 |
| D、电子式就是核外电子排布的式子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Z>W>R |
| B、对应的氢化物的热稳定性:R>W |
| C、W离子的还原性强于R离子 |
| D、W与X、W与Z形成的化合物的化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
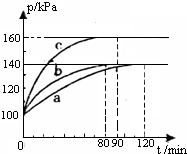 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g),反应过程如下.查看答案和解析>>
科目:高中化学 来源: 题型:
 煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
煤是重要的能,也是生产化工产品的重要原料.试用所学知识,解答下列问题:
| ||
| O2/H2O |
| n(O2) |
| n(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
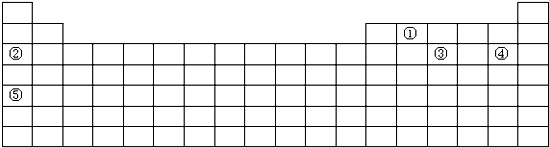
| 周期数 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com