
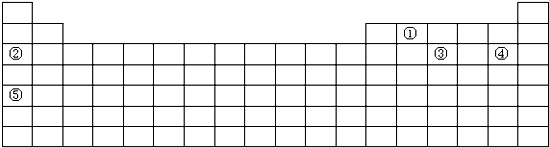
| 周期数 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
| 元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
 ,故答案为:
,故答案为: ;
; ,故答案为:
,故答案为: ;
;
| ||
| ||


科目:高中化学 来源: 题型:
 如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )
如图所示,A池用石墨电极电解氢氧化钠溶液,B池精炼粗铜.一段时间后停止通电,A池D极产生的气体在标准状况下为2.24L,则B池中E极质量的变化是( )| A、质量增加6.4g |
| B、质量增加12.8g |
| C、质量减少6.4g |
| D、质量减少12.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
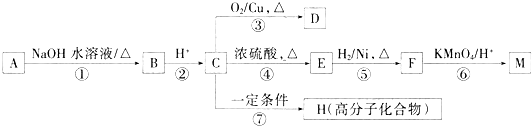
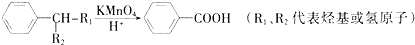
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将Al2(SO4)3溶液蒸干、灼烧至恒重,最终剩余固体是Al2O3 |
| B、将某气体通入品红溶液中,品红溶液褪色,则此气体一定是SO2 |
| C、取少许某溶液,滴加数滴KSCN溶液,无明显现象;再另取少许原溶液,先滴少量新制氯水,再滴加数滴KSCN溶液,溶液变血红色,则原溶液中一定含Fe2+ |
| D、在淀粉溶液中加入稀硫酸并加热片刻后,再加入适量银氨溶液,水浴加热后没有银镜生成,说明淀粉没有水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
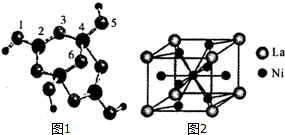
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硝酸是易挥发的强酸 |
| B、纯碱溶液能使酚酞溶液品红色 |
| C、CO是无色难溶于水的气体 |
| D、Fe3+可以与KSCN溶液反应生成血红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、△H1<△H2 |
| B、△H1=△H2 |
| C、△H1>△H2 |
| D、无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com