
| A、N2 与O2 |
| B、CO与N2 |
| C、NO2 与O3 |
| D、HCl和H2S |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶质 | Na2CO3 | NaHCO3 | Na2SiO3 | Na2SO3 | NaHSO3 | NaCl O |
| pH | 11.6 | 9.7 | 12.3 | 10.0 | 4.0 | 10.3 |
| A、Cl2和Na2CO3按物质的量之比1:1反应的化学方程式为:Cl2+Na2CO3+H2O=HClO+NaHCO3+NaCl |
| B、相同条件下电离程度比较:HCO3->HSO3->HClO |
| C、6种溶液中,Na2SiO3溶液中水的电离程度最小 |
| D、NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32?)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
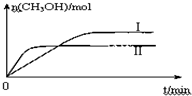 某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1
某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ?mol-1查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2 1 |
18 8 |
18 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、食盐可做调味剂,但不可作防腐剂 |
| B、喝纯净水比喝矿泉水更有利于人体健康 |
| C、淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
| D、向含有Hg2+的废水中加入Na2S,使Hg2+转化成HgS沉淀除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11:2 | B、9:2 |
| C、2:11 | D、2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com