
【题目】![]() 的
的![]() 溶液加水稀释100倍后,pH______
溶液加水稀释100倍后,pH______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ,原因是______
,原因是______![]() 用离子方程式和必要的文字说明
用离子方程式和必要的文字说明![]() ;pH相等的NaOH溶液与
;pH相等的NaOH溶液与![]() 溶液,分别加热到相同的温度后
溶液,分别加热到相同的温度后![]() 溶液的pH______NaOH溶液的
溶液的pH______NaOH溶液的![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 相等时,
相等时,![]() 三种溶液中
三种溶液中![]() 由大到小的顺序为______;
由大到小的顺序为______;
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ______ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ______ 性,溶液中![]() ______
______ ![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈______性,溶液中
的醋酸等体积混合后溶液呈______性,溶液中![]() ______
______ ![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() ,用
,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图。
某一元酸HA溶液所得滴定曲线如图。
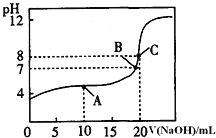
![]() 为减小实验误差,由图可知滴定时指示剂应选用______
为减小实验误差,由图可知滴定时指示剂应选用______![]() 填“石蕊”、“酚酞”、“甲基橙”
填“石蕊”、“酚酞”、“甲基橙”![]() ;
;
![]() 、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() ,A点的离子浓度大小关系是 ______ .
,A点的离子浓度大小关系是 ______ .
【答案】![]() CH3COO-+H2O
CH3COO-+H2O![]() CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,产生
CH3COOH+OH-,加水稀释后醋酸根离子的水解程度增大,产生![]() 增多,抵消掉部分溶液体积增大的影响,则溶液的
增多,抵消掉部分溶液体积增大的影响,则溶液的![]()
![]()
![]() 碱
碱 ![]() 酸
酸 ![]() 酚酞 C
酚酞 C ![]()
【解析】
(1)醋酸根离子水解溶液显碱性,![]() ,加水稀释后醋酸根离子的水解程度增大;pH相等的NaOH溶液与
,加水稀释后醋酸根离子的水解程度增大;pH相等的NaOH溶液与![]() 溶液,醋酸钠为强碱弱酸盐,加热后醋酸根离子的水解程度增大,以此解答;
溶液,醋酸钠为强碱弱酸盐,加热后醋酸根离子的水解程度增大,以此解答;
(2)相同pH的![]() 与
与![]() 溶液,
溶液,![]() 与
与![]() 都是强酸弱碱盐,根据溶液呈电中性可判断二者
都是强酸弱碱盐,根据溶液呈电中性可判断二者![]() 浓度相等,由于
浓度相等,由于![]() 电离时产生
电离时产生![]() 使溶液呈酸性,
使溶液呈酸性,![]() 的水解被抑制,以此判断;
的水解被抑制,以此判断;
(3)等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,![]() ,
,![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸溶液中氢氧根离子浓度和氢离子浓度相同;
的醋酸溶液中氢氧根离子浓度和氢离子浓度相同;
(4)碱性变色范围内的指示剂是酚酞,C点恰好反应生成盐,离子浓度最大,导电能力最强,以此判断。
![]() 的
的![]() 溶液加水稀释100倍后,由于醋酸根离子水解溶液显碱性,
溶液加水稀释100倍后,由于醋酸根离子水解溶液显碱性,![]() ,加水稀释后醋酸根离子的水解程度增大,产生
,加水稀释后醋酸根离子的水解程度增大,产生![]() 增多,抵消掉部分溶液体积增大的影响,则溶液的
增多,抵消掉部分溶液体积增大的影响,则溶液的![]() ;pH相等的NaOH溶液与
;pH相等的NaOH溶液与![]() 溶液,醋酸钠为强碱弱酸盐,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后
溶液,醋酸钠为强碱弱酸盐,加热后醋酸根离子的水解程度增大,则溶液pH增大,所以分别加热到相同的温度后![]() 溶液的
溶液的![]() 溶液的pH,故答案为:
溶液的pH,故答案为:![]() ;
;![]() ,加水稀释后醋酸根离子的水解程度增大,产生
,加水稀释后醋酸根离子的水解程度增大,产生![]() 增多,抵消掉部分溶液体积增大的影响,则溶液的
增多,抵消掉部分溶液体积增大的影响,则溶液的![]() ;
;![]() ;
;
![]() 相同pH的
相同pH的![]() 与
与![]() 溶液,
溶液,![]() 与
与![]() 都是强酸弱碱盐,根据溶液呈电中性可判断二者
都是强酸弱碱盐,根据溶液呈电中性可判断二者![]() 浓度相等,由于
浓度相等,由于![]() 电离时产生
电离时产生![]() 使溶液呈酸性,
使溶液呈酸性,![]() 的水解被抑制,因此
的水解被抑制,因此![]() 中
中![]() 的浓度小于
的浓度小于![]() ,则溶液中铵根离子浓度大小为:
,则溶液中铵根离子浓度大小为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,
等体积、等浓度的氢氧化钠与醋酸混合,恰好反应生成醋酸钠溶液,溶液中的醋酸根离子水解溶液显碱性,钠离子浓度大于醋酸根离子,![]() ,
,![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,
的醋酸溶液中氢氧根离子浓度和氢离子浓度相同,等体积混合后醋酸又电离出氢离子,溶液显酸性,醋酸根离子浓度大于钠离子浓度,![]() ,故答案为:碱;
,故答案为:碱;![]() ;酸;
;酸;![]() ;
;
![]() 由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂是酚酞,C点恰好反应生成盐,离子浓度最大,导电能力最强;A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于
由图两者恰好完全反应,溶液呈碱性,应选择碱性变色范围内的指示剂是酚酞,C点恰好反应生成盐,离子浓度最大,导电能力最强;A点时,溶液中的溶质为等浓度的NaA和HA,溶液呈酸性,所以HA的电离程度大于![]() 的水解程度,所以溶液中离子浓度大小的关系为
的水解程度,所以溶液中离子浓度大小的关系为![]() ,故答案为:
,故答案为:![]() 酚酞;
酚酞;![]() ;
;![]()


科目:高中化学 来源: 题型:
【题目】高温下,某可逆反应达到平衡,其平衡常数为K= ![]() ,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
,恒容时,升高温度,H2的浓度减小,则下列说法正确的是
A.该反应的化学方程式为CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
B.升高温度,K值减小
C.升高温度,逆反应速率减小
D.该反应的焓变为正值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应X(g) + Y![]() Z(g)中,其中Z是有色气体,当达到平衡时,下列叙述正确的是
Z(g)中,其中Z是有色气体,当达到平衡时,下列叙述正确的是
A.增大压强,平衡体系颜色加深,说明Y必是气体
B.增大压强,当c(X)= c(Z) 时,则再次达到平衡
C.若Y是气体,增大X的浓度会使Y的转化率增大,化学平衡常数也增大
D.升温,Z的质量分数减小,说明正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)室温下,pH=3的CH3COOH溶液加水稀释到原体积的10倍,溶液的pH值范围_____;
(2)室温下,pH=1和pH=3的硫酸等体积混合后溶液的pH=_____(lg2=0.3、lg3=0.477、lg5=0.7)
(3)在25℃时,100ml 0.6mol/L的盐酸与等体积0.4mol/L的氢氧化钠溶液混合后,溶液pH=______
Ⅱ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是(用字母填写)_____→_____→_____→D→_____。
(2)D步骤中尖嘴部分应_____________________。
(3)滴定终点时锥形瓶中颜色变化____________。
(4)若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?_____(填“偏高”、“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为____mol·L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是____。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH-=NO2-+NO3-+H2O和NO+NO2+2OH-=____+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为____。
②Cu与Cu2O的物质的量之比为____。
③HNO3的物质的量浓度为____mol·L-1。
(4)有H2SO4和HNO3的混合溶液20mL,加入0.25molL-1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为____mol·L-1,HNO3的物质的量浓度为____mol·L-1。
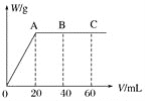
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用铝热炼镁还原渣[Al、Ca(AlO2)2、Al2O3、MgO及少量不能被碱液溶出的尖晶石型铝的化合物等]制取Al(OH)3的工艺流程如下:
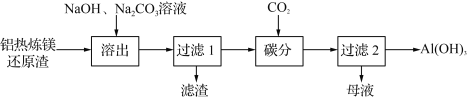
(1) “滤渣”成分包括:水合铝酸钙、尖晶石型铝的化合物、不含铝的化合物______________(写两种物质的化学式)。
(2) “溶出”时,在适当条件下,铝及其大部分含铝化合物以NaAlO2溶出。
①金属Al与NaOH溶液反应的化学方程式为________________________________。
②其他条件相同时,Na2CO3、NaOH溶液的浓度对铝的溶出率的影响如图所示:
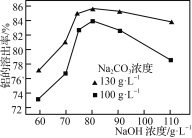
NaOH溶液浓度一定时,130 g·L-1的Na2CO3溶液对铝的溶出率比100 g·L-1的大,这是因为______________(从平衡移动角度分析);Na2CO3溶液浓度一定时,当NaOH溶液浓度大于80 g·L-1,铝的溶出率随NaOH溶液浓度增大而减小,可能原因是______________。
(3) “碳分”时,溶液与过量CO2反应的离子方程式为________________________。
(4) “过滤2”的母液经再生处理可返回“溶出”工序循环使用,再生的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是由常见元素组成的一些单质及其化合物之间的转化关系图。各方框表示有关的一种反应物或生成物(部分物质已经略去)。其中A、B、D在常温下均为无色无味的气体,C是能使湿润的红色石蕊试纸变蓝的气体,M是最常见的无色液体。

(1)写出C→E的化学方程式: 。
(2)实验室常用加热两种固体混合物的方法制备物质C,其化学方程式为: ,干燥C常用 (填写试剂名称)。
(3)E物质遇到D物质时,会观察到 现象,若用排水法收集F,则最终集气瓶中收集到的气体为 (填写物质的化学式)。
(4)写出A→D的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关化学反应原理的说法正确的是( )
A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.反应物的热效应与是否使用催化剂无关
C.已知中和热![]()
![]() ,则1mol浓
,则1mol浓![]() 和1mol
和1mol![]() 的反应热
的反应热![]()
D.向![]() 溶液中通入少量HCl气体,溶液的导电性明显增强
溶液中通入少量HCl气体,溶液的导电性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答以下问题:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是__________________________。
(2)另称取已去除表面氧化物的铁钉(碳素钢)6.0g放入15.0ml浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除Fe3+外还可能含有Fe2+。写出生成Fe2+所有可能的离子方程式:______________。
②乙同学取336mL(标准状况)气体Y通入足量氯水中,发生反应的化学方程式为:______________。
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中SO2的体积分数为___________。
(3)向100mL水中投入Na和Al共16克,充分反应后剩余金属1g。计算放出H2的体积为________升(标准状况下)
(4)向含有0.3mol NaAlO2的溶液中滴加1mol/L HCl,当生成7.8克沉淀时,加入盐酸的体积为________mL
(5)向一定量的Fe、Fe2O3和CuO混合物投入120 ml 2.2 mol/L的硫酸溶液中,充分反应后生成896 mL标准状况下的气体,得不溶物1.28 g,过滤后,向滤液中加入2 mol/L的NaOH溶液,加至40 mL时开始出现沉淀,则滤液中FeSO4的物质的量浓度为(设滤液体积为120 ml)_________mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com