
【题目】花青醛( )具有一种清新的花香,对香水和洗涤护理配方也非常有价值,下图是用Michael反应合成花青醛的一种合成路线。
)具有一种清新的花香,对香水和洗涤护理配方也非常有价值,下图是用Michael反应合成花青醛的一种合成路线。

已知:氨基连接在苯环上易被氧化。
回答下列问题:
(1)花青醛I中官能团的名称是___,可通过 直接判定___(选填编号)。
a.质谱 b.红外光谱 c.核磁共振氢谱
(2)A→B的反应方程式为___。
(3)B→C、C→D的反应类型分别是___、___。
(4)E的结构简式为____。
(5)对比分析说明,引入C→D与E→F步骤的目的是___。
(6)有机物G有多种同分异构体, 写出满足下列条件的一种同分异构体___。
①苯环上有3个取代基;②核磁共振氢谱有4个峰
(7)利用Michael反应, 以丙烯和 为原料合成
为原料合成 , 写出合成路线(无机试剂任选) ___。
, 写出合成路线(无机试剂任选) ___。
【答案】醛基 b 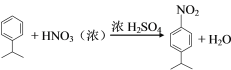 还原反应 取代反应
还原反应 取代反应 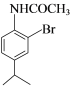 防止氨基被氧化(或保护氨基)
防止氨基被氧化(或保护氨基) 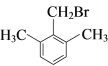 或
或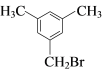
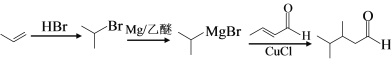
【解析】
A ![]() 在浓硫酸催化下与硝酸发生取代反应生成B,B为
在浓硫酸催化下与硝酸发生取代反应生成B,B为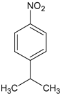 ,B上的硝基用Fe和HCl还原成氨基生成C,C为
,B上的硝基用Fe和HCl还原成氨基生成C,C为![]() ,C在乙酸酐作用下生成D
,C在乙酸酐作用下生成D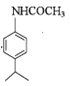 ,将氨基保护起来,再进行卤代,生成E,E为
,将氨基保护起来,再进行卤代,生成E,E为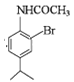 ,E在碱性条件下,水解生成F,F为
,E在碱性条件下,水解生成F,F为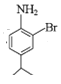 ,与NaNO2在酸性条件下转化为
,与NaNO2在酸性条件下转化为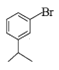 ,g在乙醚中与Mg反应生成H
,g在乙醚中与Mg反应生成H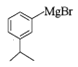 ,H与
,H与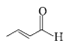 合I。
合I。
(1)花青醛I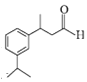 中官能团的名称是醛基,可通过红外光谱直接判定,故选b;
中官能团的名称是醛基,可通过红外光谱直接判定,故选b;
故答案为:醛基;b;
(2)A ![]() 在浓硫酸催化下与硝酸发生取代反应生成B
在浓硫酸催化下与硝酸发生取代反应生成B![]() ,A→B的反应方程式为
,A→B的反应方程式为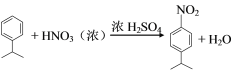 。故答案为:
。故答案为: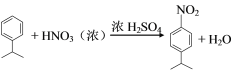 ;
;
(3)B上的硝基用Fe和HCl还原成氨基生成C![]() ,C在乙酸酐作用下发生取代反应生成D
,C在乙酸酐作用下发生取代反应生成D ,B→C、C→D的反应类型分别是还原反应、取代反应。故答案为:还原反应、取代反应;
,B→C、C→D的反应类型分别是还原反应、取代反应。故答案为:还原反应、取代反应;
(4)E的结构简式为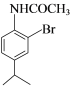 。故答案为:
。故答案为: ;
;
(5)对比分析说明,引入C→D与E→F步骤的目的是防止氨基被氧化(或保护氨基)。故答案为:防止氨基被氧化(或保护氨基);
(6)有机物G有多种同分异构体, 满足下列条件①苯环上有3个取代基;②核磁共振氢谱有4个峰,说明有一个对称轴,可能的一种同分异构体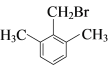 或
或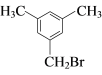 。
。
故答案为: 或
或 ;
;
(7)利用Michael反应, 以丙烯和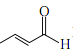 为原料合成
为原料合成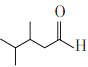 , 先将丙烯与HBr加成生成2-溴丙烷,与Mg生成
, 先将丙烯与HBr加成生成2-溴丙烷,与Mg生成![]() ,利用Michael反应,合成
,利用Michael反应,合成 ,合成路线(无机试剂任选)
,合成路线(无机试剂任选)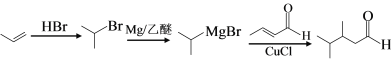 。
。
故答案为: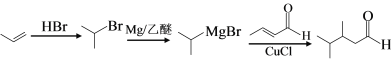 。
。


科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如图所示(![]() N
N![]() O)。下列说法不正确的是( )
O)。下列说法不正确的是( )
![]()
A.NO属于极性分子
B.含有非极性共价键
C.过程②释放能量,过程③吸收能量
D.标准状况下,NO分解生成5.6LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、 Y、 Z、 M、 Q、 R为短周期元素, 其原子半径和最外层电子数之间的关系如图所示。下列说法错误的是

A.元素的金属性: Q<RB.R 的氧化物可能含共价键
C.热稳定性: ZX3<YX4D.X2M 的水溶液露置于空气中易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)50mL0.5mol·L-1的盐酸与50mL0.55mol·L-1的NaOH溶液在下图所示的位置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,可知下图装置有三处不妥之处,请指出____________。
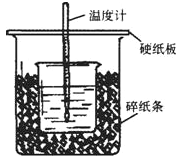
(2)在测定中和热的实验中,计算反应热时需要的数据有_________
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应前后溶液的温度差 ⑤操作所需时间
A.①②③⑤ B. ①②③④ C. ②③④⑤ D. ①③④⑤
(3)实验中改用60mL0.50mol·L-1的盐酸跟50mL0.55mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________(填“相等”或“不相等”),所放出的热量________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会______(填“偏大”、“偏小”或“无影响”).
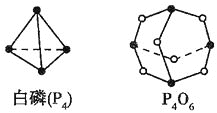
(Ⅱ)(5)化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量,已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能:![]() :
:![]() kJ·mol-1,
kJ·mol-1,![]() :
:![]() kJ·mol-1,
kJ·mol-1,![]() :
:![]() kJ·mol-1,则反应P4(白磷)+3O2=P4O6的热化学反应方程式为__________________。
kJ·mol-1,则反应P4(白磷)+3O2=P4O6的热化学反应方程式为__________________。
(6)肼(N2H4)可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)═N2O4(l) △H1═-19.5kJmol-1
②N2H4(l)+O2(g)═N2(g)+2H2O(g) △H2═-534.2kJmol-1
写出肼和N2O4反应的热化学方程式___________________ 。
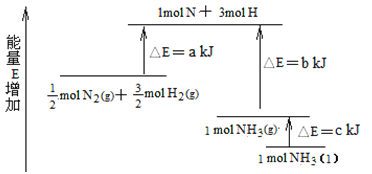
(7)化学反应N2+3H2![]() 2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________。
2NH3的能量变化如图所示,该反应生成NH3(I)的热化学方程式是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在工业、农业和国防科技中有重要应用,我国已是生产钢铁最多的国家。回答下列问题:
(1) 工业上以磁铁矿和焦炭为原料冶炼铁存在以下变化:
①Fe3O4(s)+4C(s)=3Fe(s)+4CO(g) ΔH1=+678kJ·mol-1 ②CO(g)+![]() O2(g)=CO2(g) ΔH2=-283kJ·mol-1
O2(g)=CO2(g) ΔH2=-283kJ·mol-1
③C(s) +![]() O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
O2(g)=CO(g) ΔH3=-110kJ·mol-1 ④Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g) ΔH4
则ΔH4=____kJ·mol-1。
(2)铁矿石中常含有硫, 使高炉尾气中混有SO2, 除去高炉尾气中SO2 的物质是___。生产中发现, 无论怎么改变原料配比与条件, 在高炉尾气中始终有CO, 原因是___。
(3)在温度 aK时,反应Fe3O4(s)+4CO(g)3Fe(s)+4CO2(g)的浓度平衡常数Kc=16(用浓度计算所得),则用分压(分压等于总压×体积分数)代替浓度算得的平衡常数Kp ___Kc(填 “大于”“小于” 或 “等于”)。平衡混合气体中CO的体积分数为___(保留两位有效数字)。
(4) aK 时,在体积为 2L 的密闭容器中,加入 Fe、 Fe3O4、 CO、 CO2各1.0mol,气体的压强为PkPa。
①此时,v 正(CO2) ___v 逆(CO)(填 “大于”“小于” 或 “等于”), 反应经过5min后达到平衡, 该时间范围内的平均反应速率 v(CO2)=___mol/(L·min)(保留两位有效数字)。
②已知:恒容条件下,相同分子数的气体,其压强与温度成正比。平衡后温度从 aK逐渐升高到3aK, 请在下图中绘制出CO分压(PCO的变化曲线)_______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+116.5kJ/mol
③H2O(l)= H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____。
(2)已知:①Fe(s)+![]() O2(g)=FeO(s) ΔH1=272.0kJ/mol
O2(g)=FeO(s) ΔH1=272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) ΔH2=1675.7kJ/mol
O2(g)=Al2O3(s) ΔH2=1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是________。铝热反应的反应类型_____,某同学认为,铝热反应可用于工业炼铁,你的判断是_______(填“能”或“不能”),你的理由_________。
(3)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。已知:25℃、101kPa下:
①H2(g)+![]() O2(g)=H2O(g) ΔH1=242kJ/mol
O2(g)=H2O(g) ΔH1=242kJ/mol
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g) ΔH2=676kJ/mol
O2(g)=CO2(g)+2H2O(g) ΔH2=676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.乙酸与乙醇的酯化反应:CH3COOH+C2H518OH![]() CH3COOC2H5+H218O
CH3COOC2H5+H218O
B.镁离子的结构示意图:![]()
C.二氧化碳分子的比例模型:![]()
D.NaCl溶液导电:NaCl![]() Na++Cl
Na++Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol·L-1·s-1,则10秒钟时,容器中B的物质的量是
A. 0.6 molB. 2.8 molC. 1.4 molD. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 0.1mol氯气通入水中,转移电子的数目为0.1NA
B. 常温常压下,7.8g过氧化钠含有阴离子的数目为0.2NA
C. 标准状况下,22.4LCl2与足量的铁充分反应,转移电子数为3NA
D. 1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com