
| A. | 制造人民币所用的棉花、优质针叶木等原料的主要成分是纤维素 | |
| B. | 西非国家曾爆发埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 | |
| C. | 硅胶可用作食品干燥剂 | |
| D. | 燃料脱硫,脱氮都是减少酸雨的有效措施 |
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 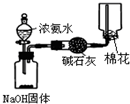 制取收集干燥纯净的NH3 | B. |  称NaOH固体的质量 | ||
| C. | 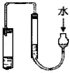 检查此装置的气密性 | D. |  可进行碘水中碘的萃取及分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素在人体内不能被消化吸收,可帮助消化 | |
| B. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 | |
| C. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| D. | 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
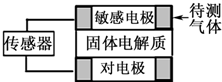 气体自动化检测的探头应用了原电池原理:气体扩散进入敏感电极,发生原电池反应产生电信号,传感器通过对电信号进行分析、判断从而得到结论.如表列出了部分待测气体及敏感电极上部分产物.下列有关说法正确的是( )
气体自动化检测的探头应用了原电池原理:气体扩散进入敏感电极,发生原电池反应产生电信号,传感器通过对电信号进行分析、判断从而得到结论.如表列出了部分待测气体及敏感电极上部分产物.下列有关说法正确的是( ) | 待测气体 | 部分电极反应产物 |
| NO | N2 |
| H2 | H2O |
| CO | CO2 |
| SO2 | SO3 |
| A. | 检测上述气体时,电流均从对电极流向敏感电极 | |
| B. | 检测汽车尾气中的CO时,传感器中通过的电流越大,尾气中CO的含量越高 | |
| C. | 检测SO2时,对电极充入空气,对电极上的电极反应为O2+4H++4e-═2H2O | |
| D. | 检测NO时,敏感电极的电极反应式为:2NO-4e-=N2+2O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | Na2SO4溶液 | AgNO3溶液 | 现象 | ||
| 体积/mL | 浓度/(mol•L-1) | 体积 | 浓度/(mol•L-1) | ||
| ① | 1 | 1 | 3滴 | 2 | 出现大量白色沉淀 |
| ② | 1 | 1 | 3滴 | 0.5 | 出现少量白色沉淀 |
| ③ | 1 | 1 | 3滴 | 0.1 | 有些许浑浊 |
| ④ | 1 | 1 | 3滴 | 0.01 | 无明显变化 |
| 编号 | AgNO3浓度/(mol•L-) | 稀释后Ag+浓度/(mol•L-1) | 混合溶液中SO42-的最小理论检出浓度/(mol•L-1) |
| ① | 2 | 0.2 | 0.0003 |
| ② | 0.5 | 0.0048 | |
| ③ | 0.1 | 0.01 | 0.12 |
| ④ | 0.01 | 0.001 |
| 编号 | AgNO3浓度/(mol•L-1) | 现象 | 向沉淀中滴加硝酸后的现象 |
| ① | 2 | 出现大量白色沉淀 | 滴加稀硝酸,沉淀大量溶解;改加浓硝酸,沉淀较快消失 |
| ② | 0.5 | 出现少量白色沉淀 | 滴加稀硝酸,沉淀基本消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3是两性氧化物,既能与所有的酸反应,也能与所有的碱反应 | |
| B. | 铝制容器可盛装热的浓H2SO4 | |
| C. | 明矾[KAl(SO4)2•12H2O]的水溶液能够杀菌消毒,可用做净水剂 | |
| D. | 向AlCl3溶液中加入过量氨水后,蒸干并灼烧可得到Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com