
【题目】描述弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
酸或碱 | 电离平衡常数(Ka或Kb) |
CH3COOH | 1.8×10-5 |
HNO2 | 4.6×10-4 |
HCN | 5×10-10 |
HClO | 3×10-8 |
NH3·H2O | 1.8×10-5 |
表2
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1×10-10 |
BaCO3 | 2.6×10-9 |
CaSO4 | 7×10-5 |
CaCO3 | 5×10-9 |
请回答下列问题:
(1)表1所给的四种酸中,酸性最弱的是________(用化学式表示)。下列能使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是________(填字母序号)。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)CH3COONH4的水溶液呈________(选填“酸性”、“中性”或“碱性”),该溶液中存在的各离子浓度大小关系是_____________________________。
(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH >7,该溶液中离子浓度从大到小的排列为________________________。
(4)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如BaCl2)。具体做法是用饱和的纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度不小于0.01 mol·L-1,则溶液中CO32-物质的量浓度应 ≥ ______________。
【答案】(1)HCN; B; (2)中性; c(NH)=c(CH3COO-)>c(OH-)=c(H+) ;
(3)c(Na+)>c(CN-)>c(OH-)>c(H+); (4)0.26 mol/L.
【解析】
试题分析:(1)在相同温度下,酸越弱,电离平衡常数就越小。由表1可知电离平衡常数最小的是HCN。因此酸性最弱的是HCN。醋酸是弱电解质,在溶液中存在CH3COOH的电离平衡:CH3COOH![]() CH3COO-+H+。A.升高温度,促进电离,程度增大,但是平衡常数会增大。错误。B.加水稀释,由于离子浓度减小,所以平衡正向移动,电离程度增大,由于温度不变,所以电离常数不变。正确。C.加少量的CH3COONa固体,抑制酸的电离,电离程度减小。错误。D.加少量冰醋酸,对酸的电离起抑制作用。物质的浓度越大,物质的大量程度反而越小。错误。(2)CH3COONH4是弱酸弱碱盐,由于弱酸根离子与弱碱根离子水解程度相差不大,因此该物质的水溶液呈中性。根据电荷守恒可得c(NH)+ c(H+)=c(CH3COO-)+c(OH-);由于溶液为中性,所以c(OH-)=c(H+) ;,盐的大量原大于弱电解质水的电离,因此微粒浓度关系是c(NH)=c(CH3COO-)>c(OH-)=c(H+) ;(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,说明CN-的水解作用大于HCN的电离作用。根据物料守恒可得c(Na+)>c(CN-),因为溶液显碱性,所以c(OH-)> c(H+)。强电解质的电离大于弱电解质的电离,所以c(CN-) c(OH-)。因此微粒的浓度关系是c(Na+)>c(CN-)>c(OH-)>c(H+);(4)Ksp(BaSO4)= 1×10-10=c(Ba2+)·c(SO42-), Ksp(BaCO3)= 2.6×10-9
CH3COO-+H+。A.升高温度,促进电离,程度增大,但是平衡常数会增大。错误。B.加水稀释,由于离子浓度减小,所以平衡正向移动,电离程度增大,由于温度不变,所以电离常数不变。正确。C.加少量的CH3COONa固体,抑制酸的电离,电离程度减小。错误。D.加少量冰醋酸,对酸的电离起抑制作用。物质的浓度越大,物质的大量程度反而越小。错误。(2)CH3COONH4是弱酸弱碱盐,由于弱酸根离子与弱碱根离子水解程度相差不大,因此该物质的水溶液呈中性。根据电荷守恒可得c(NH)+ c(H+)=c(CH3COO-)+c(OH-);由于溶液为中性,所以c(OH-)=c(H+) ;,盐的大量原大于弱电解质水的电离,因此微粒浓度关系是c(NH)=c(CH3COO-)>c(OH-)=c(H+) ;(3)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,说明CN-的水解作用大于HCN的电离作用。根据物料守恒可得c(Na+)>c(CN-),因为溶液显碱性,所以c(OH-)> c(H+)。强电解质的电离大于弱电解质的电离,所以c(CN-) c(OH-)。因此微粒的浓度关系是c(Na+)>c(CN-)>c(OH-)>c(H+);(4)Ksp(BaSO4)= 1×10-10=c(Ba2+)·c(SO42-), Ksp(BaCO3)= 2.6×10-9
=c(Ba2+)·c(CO32-), Ksp(BaCO3)÷Ksp(BaSO4)= c(CO32-)÷c(SO42-);所以c(CO32-)= Ksp(BaCO3)÷Ksp(BaSO4)×c(SO42-)= 2.6×10-9÷1×10-10×0.01 mol/L=0.26 mol/L.


科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:
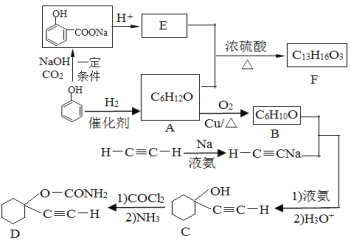
(1)A的化学名称是___________,C中含氧官能团的名称为__________。
(2)F的结构简式为____________________________。
(3)A生成B的化学方程式为_______________________________。
(4)写出由C合成D的第二个反应的化学方程式_____________________。
(5)同时满足下列条件的E的同分异构体有_____________种(不含立体异构)。
①遇FeCl3溶液发生显色反应 ②能发生银镜反应
(6)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L密闭容器中发生下列反应:4NO2(g)+O2(g)![]() 2N2O5(g);已知该反应的平衡常数:K300℃>K350℃,且体系中n(NO2)(单位:mol)随时间变化如下表:
2N2O5(g);已知该反应的平衡常数:K300℃>K350℃,且体系中n(NO2)(单位:mol)随时间变化如下表:
时间(s) | 0 | 500 | 1000 | 1500 |
t1℃ | 20 | 13.96 | 10.08 | 10.08 |
t2℃ | 20 | a | b | c |
下列说法一定正确的是
A. 正反应为吸热反应
B. 如果t2℃<t1℃,那么a>b=c,且a=10+0.5b
C. 如果t2℃<t1℃,那么t2℃达到平衡的时间介于1000s至1500s之间
D. 如果t2℃>t1℃,那么b>10.08
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期主族元素X、Y、Z、W,其中X、Z、W与氢元素可组成XH3、H2Z和HW共价化合物;Y与氧元素可组成Y2O和Y2O2离子化合物。
(1)写出Y2O2的电子式:__,其中含有的化学键是__。
(2)将ZO2通入品红溶液再加热的现象是__。
(3)写出X的最高价氧化物对应的水化物的稀溶液与铜反应的化学方程式__。
(4)XH3、H2Z和HW三种化合物,其中一种与另外两种都能反应的是_(填化学式)。
(5)由X、W组成的化合物分子中,X、W原子的最外层均达到8电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Mg—Cu合金11.2g完全溶解于硝酸中,反应产生的X气体,再向所得溶液中加入NaOH溶液,恰好完全反应时产生21.4g沉淀,根据题意推断X气体的成份可能是
A. 0.3molNO
B. 0.2molNO2和0.1molN2O4
C. 0.1molNO、0.2molNO2和0.05molN2O4
D. 0.1molNO、0.1molNO2和0.2molN2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平 ② 2CH3CHO+O2![]() 2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
2CH3COOH。现以A为主要原料合成乙酸乙酯,其合成路线如图所示:
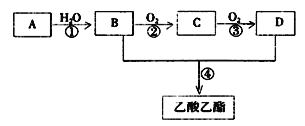
回答下列问题:
(1)B、D分子中的官能团名称分别是____、_____。
(2)写出下列反应的反应类型:①________,②__________,④_________。
(3)写出下列反应的化学方程式:
①__________;
②__________;
④__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是重要的核工业原料。下列有关
是重要的核工业原料。下列有关![]() 、
、![]() 说法正确的是
说法正确的是
A. ![]() 原子核中含有92个中子 B.
原子核中含有92个中子 B. ![]() 原子核外有143个电子
原子核外有143个电子
C. ![]() 与
与![]() 互为同位素 D.
互为同位素 D. ![]() 与
与![]() 互为同素异形体
互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类发现的第二个生命科学必需微量元素。回答下列问题:
(1)碘与氯是同族元素,它们位于元素周期表的第___族;HI的还原性比HCl___(填“强”或“弱”)。
(2)自然界中的碘有的以NaIO3形态存在于硝石(NaNO3)中,向硝石母液中加入NaHSO3可以制得I2,请写出NaIO3溶液和NaHSO3溶液反应的离子方程式____。
(3)碘还以碘化物的形态存在于海水中,被海藻类植物吸收而富集,从海带中提取碘的过程如下:

步骤③的操作名称为__;步骤④发生反应的离子方程式为___;步骤⑤的实验操作为____;
(4)步骤③得到的滤液中c(I-)=0.004mol/L,取10mL滤液加入10mLPb(NO3)2溶液,若要生成PbI2沉淀,则所加Pb(NO3)2溶液的浓度应大于___mol/L[已知Ksp(PbI2)=9.8×10-9]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:

回答下列问题:
(1)A的结构简式为____________。C的化学名称是______________。
(2)③的反应试剂和反应条件分别是____________________,该反应的类型是__________。
(3)⑤的反应方程式为_______________。吡啶是一种有机碱,其作用是____________。
(4)G的分子式为______________。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有______种。
(6)4-甲氧基乙酰苯胺(![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚(![]() )制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线___________(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com