
 某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.
某稀硫酸和硝酸的混合溶液200mL,分成两份.向其中一份逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO).向另一份逐渐加入铁粉,产生气体的量随铁粉质量增加的变化曲线如图所示.| n |
| V |
| 11.2g |
| 56g/mol |
| 22.4g |
| 56g/mol |
| 0.4mol |
| 0.1L |


科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
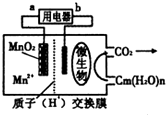
| A、电池工作时,电子由a流向b |
| B、微生物所在电极区放电时发生还原反应 |
| C、放电过程中,H+从正极区移向负极区 |
| D、正极反应式为:MnO2+4H++2e-═Mn2++2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该装置为电能转化为化学能的装置 |
| B、a电极发生的电极反应为CH3OH-6e-+H2O═CO2↑+6H+ |
| C、当电路中有1 mol e-转移时,正极区n(H+)增加1 mol |
| D、将酸性电解质溶液改为碱性电解质溶液该测试仪不可能产生电流 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol[Cu(NH3)2]2+中含有σ键的数目为12NA |
| B、0.1mol铁粉与足量水蒸气反应生成的H2分子数目为0.1NA |
| C、分子数目为0.1NA的N2和NH3混合气体,原子间含有的公共电子数目为0.3NA |
| D、用惰性电极电解CuSO4溶液一段时间后,若加入0.05mol的Cu2(OH)2CO3固体恰好能使溶液恢复到原来的浓度,则该电解过程中转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 目的 | 操作 |
| A | 检验Fe2(SO4)3溶液中是否含有FeSO4 | 取少量溶液于试管,加入几滴0.1mol/L KMnO4溶液 |
| B | 证明Al(OH)3是两性氢氧化物 | 取Al(OH)3于试管A、B,分别滴加氨水与盐酸 |
| C | 比较S与P元素非金属性强弱 | 测定等浓度H2SO3、H3PO4的pH |
| D | 除去Na2CO3中的NaCl | 溶解,加入AgNO3溶液至不再产生沉淀,静置,过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油裂解和油脂皂化都有高分子生成小分子的过程 |
| B、NOx、CO2、PM2.5颗粒都会导致酸雨 |
| C、工业上制备铝可用热还原的方法 |
| D、高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-═Al(OH) 3↓+HCO3- |
| B | Fe3+、I-、ClO- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、Na+、OH- | NaCO3溶液 | HCO3-+OH-═CO32-+H2O |
| D | NH4+、HCO3-、Cl- | NaOH溶液 | NH4++HCO3-+2OH-═CO32-+NH3.H2O |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com