

| A. | 铂是非金属元素,在常温下呈固态 | B. | “78”是铂的原子序数 | ||
| C. | “195.1”是铂的质量数 | D. | 铂的名称为Pt |
科目:高中化学 来源: 题型:选择题
| A. | I-、H+、Cl-、NO3- | B. | Al3+、K+、OH-、Ba2+ | ||
| C. | Mg2+、Fe3+、Cl-、NO3- | D. | Ca2+、SO42-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+H2SO4(稀) | B. | Cu+HNO3(浓) | C. | Fe+HNO3(稀) | D. | C+H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
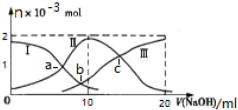 常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol•L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )| A. | 曲线Ⅱ代表H2SO3的浓度 | |
| B. | V(NaOH)=10ml时,溶液温度最高,c(H2SO3)=0.1mol•L-1 | |
| C. | 水的电离程度大小:a点<b点<c点 | |
| D. | 若c点pH=6,则K2(H2SO3)=10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④⑥ | C. | ①②⑤ | D. | ③④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
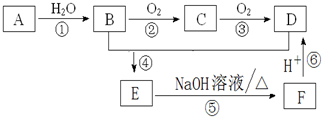
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com