
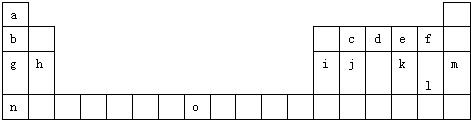
分析 由元素所在周期表中的位置可知,a为H,b为Li,c为C,d为N,e为O,f为F,g为Na,h为Mg,i为Al,j为Si,k为S,l为Cl,m为Ar,n为K,o为Fe,
(1)由元素所在周期表中的位置可知,O位于第四周期ⅤⅢ族第一列,O为Fe,外围电子排布式3d64s2;
(2)SiC和晶体Si均属于原子晶体,原子晶体的熔沸点取决于共价键的强度,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高;
(3)根据白磷分子的空间构型判断含有的共价键数目;白磷含有6个共价键,可形成化合物P4O10;
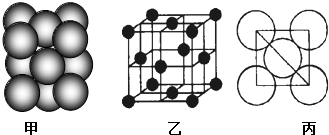
(4)①该类型为面心立方堆积,配位数=3×$\frac{1}{2}$×8=12,由图2可知占据顶点和面心,则一个晶胞中Al原子的个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4;
②根据ρ=$\frac{m}{V}$计算.
解答 解:(1)由元素所在周期表中的位置可知,O位于第四周期ⅤⅢ族第一列,O为Fe,外围电子排布式3d64s2,
故答案为:3d64s2;
(2)SiC和晶体Si均属于原子晶体,原子晶体的熔沸点取决于共价键的强度,由于C原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高,
故答案为:SiC; 因SiC晶体与晶体Si都是原子晶体,由于C的原子半径小,SiC中C-Si键键长比晶体Si中Si-Si键长短,键能大,因而熔沸点高;
(3)白磷为空心正四面体结构,键角为60°,每个P原子与3个P原子结合成共价键,每个分子中含有6个共价键,若将1分子白磷中的所有P-P键打开并各插入一个氧原子,共可结合6个O原子,若每个P原子上的孤对电子分别再以配位键连接一个氧原子,还可结合4个O原子,则可形成化合物P4O10,
故答案为:60°;正四面体;3;6;P4O10;
(4)①根据图片知,Al单质为面心立方堆积,Al原子配位数配位数=3×$\frac{1}{2}$×8=12,由图2可知占据顶点和面心,则个数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,
故答案为:面心立方堆积;12;4;
②Al原子半径为d,则晶胞边长=2$\sqrt{2}$d,晶胞体积V=(2$\sqrt{2}$d)3,每个晶胞中Al原子个数为4,则密度为ρ,$\frac{M}{NA}$=$\frac{ρ(2\sqrt{2}d)^{3}}{4}$,解得ρ=$\frac{M}{4\sqrt{2}{d}^{3}NA}$,
故答案为:$\frac{M}{4\sqrt{2}{d}^{3}NA}$.
点评 本题考查物质结构与性质,涉及元素周期表、核外电子排布规律、分子结构与性质、晶体类型与性质等,难度中等,侧重考查学生对知识运用、分析解决问题能力,注意利用“均摊法”的计算.


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
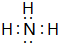 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铂是非金属元素,在常温下呈固态 | B. | “78”是铂的原子序数 | ||
| C. | “195.1”是铂的质量数 | D. | 铂的名称为Pt |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
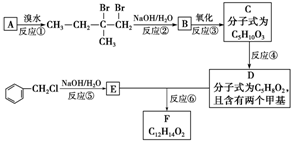
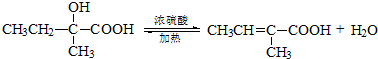 ;
;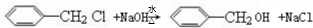 ;
; ;.
;. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用浓硝酸洗去银镜 | |
| B. | 向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液 | |
| C. | 采用水浴加热,也可以直接加热 | |
| D. | 试管先用热NaCl溶液洗涤,然后用蒸馏水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
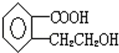 1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.
1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
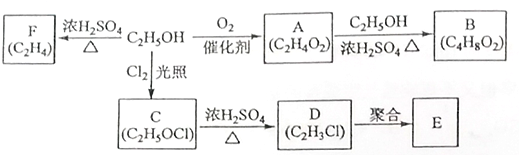
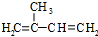 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$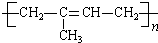 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
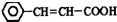 ,可由化合物甲生成.其转化关系及相应反应如下:
,可由化合物甲生成.其转化关系及相应反应如下: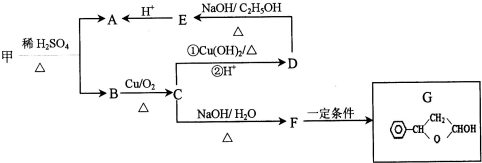

 .
. (写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为
(写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为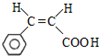 .
.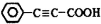 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的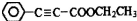 路线(其他试剂任选)
路线(其他试剂任选)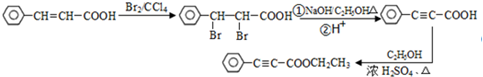 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com