
亚氯酸钠(NaClO2)是重要漂白剂。某化学兴趣小组同学展开对亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2•3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO2)2可溶于水。
利用下图所示装置进行实验。

(1)装置②中产生ClO2气体的化学方程式为 。
(2)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。过滤用到的玻璃仪器有 。
(3)设计实验检验所得NaClO2晶体是否含有杂质Na2SO4,操作是: 。
(4)反应结束后,关闭K2、打开K1,装置①的作用是 ;如果撤去D中的冷水浴,可能导致产品中混有的杂质是 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,用c mol•L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:2015-2016学年四川成都石室中学高二4月月考化学试卷(解析版) 题型:实验题
化工原料红矾钠(重铬酸钠:Na2Cr2O7•2H2O)主要是以铬铁矿(主要成份为 FeO•Cr2O3,还含有A12O3、SiO2 等杂质)为主要原料生产,其主要工艺流程如下:
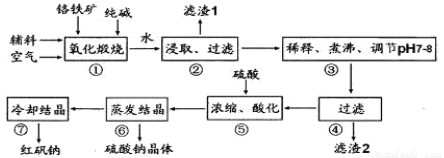
步骤①中主要反应的化学方程式为:4FeO•Cr2O3+8Na2CO3+7O2 =8Na2CrO4+2Fe2O3+8CO2
(1)杂质 A12O3、SiO2在①中转化后经加水过滤进入滤液,写出 A12O3在①中转化的化学反应方程式____________________________________。
(2)用化学平衡移动原理说明③中煮沸的作用是____________(用离子方程式结合文字说明)
(3)⑤中酸化是使 CrO42一转化为 Cr2O72一,若1L酸化后所得溶液中含铬元素的质量为 28.6 g,CrO42-有 转化为 Cr2O72-。
转化为 Cr2O72-。
①酸化后所得溶液中 c(Cr2O72- )=________
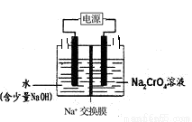
②工业上也可设计图示装置(两极均为惰性电极)电解Na2CrO4溶液制取 Na2Cr2O7,图中右侧电极的电极反应式为_________________________。若电解前两侧溶液的质量相等,则当电解过程中转移了1mol 电子时两侧溶液的质量差为______________g
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三下最后一次模拟理综化学试卷(解析版) 题型:填空题
【化学——选修2化学与技术】硫酸工业在国民经济中占有极其重要的地位。
(1)工业制硫酸时所用硫铁矿的主要成分为FeS2,其中硫元素的化合物为 。
(2)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有 (任写一种)。
(3)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。
A.矿石加入沸腾炉之前先粉碎 B.使用V2O5作催化剂
C.转化器中使用适宜的温度 D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:
2SO2(g)+O2(g) 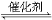 2SO3(g) ΔH=-98.3 kJ·mol-1
2SO3(g) ΔH=-98.3 kJ·mol-1
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为 。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔))。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
____________________________________________________________________。
②工业生产中常用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
______________________________________________________________________
_____________________________________________________________________。
(6)实验室可利用硫酸厂炉渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4•7H2O),聚铁的化学式为[Fe2(OH)n(SO4)3﹣0.5n]m,制备过程如图所示,下列说法正确的是 。
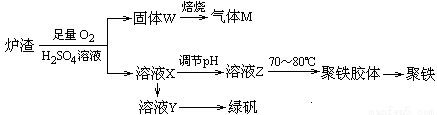
A.炉渣中FeS与硫酸和氧气的反应的离子方程式为:4FeS+3O2+12H+═4Fe3++4S↓+6H2O
B.气体M的成分是SO2,通入双氧水得到硫酸,可循环使用
C.向溶液X中加入过量铁粉,充分反应后过滤得到溶液Y,再将溶液Y蒸发结晶即可得到绿矾
D.溶液Z的pH影响聚铁中铁的质量分数,若其pH偏小,将导致聚铁中铁的质量分数偏大
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三第七次模拟理综化学试卷(解析版) 题型:选择题
下列有关实验的说法正确的是
A.向蛋白质溶液中滴加饱和Na2SO4溶液或浓硝酸均会产生白色沉淀,是因为蛋白质变性
B.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
C.某钾盐溶于盐酸,产生无色无味气体,通过澄清石灰水,石灰水变浑浊,该钾盐一定是K2CO3
D.进行K与水反应的实验操作:可在培养皿中放些水,然后取绿豆大小的钾,用滤纸吸干表面的煤油,投入培养皿中
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:实验题
[化学一选修5:有机化学基础]
相对分子质量为92的某芳香烃X是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO。
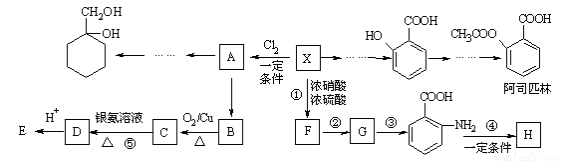
已知:Ⅰ.
Ⅱ.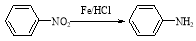 (苯胺,易被氧化)
(苯胺,易被氧化)
请根据所学知识与本题所给信息回答下列问题:
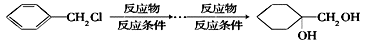
(1)X的分子式是 。
(2)H的结构简式是 。
(3)反应②③的类型是 、 。
(4)反应⑤的化学方程式是__________________________________。
(5)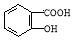 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种。
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有 种。
(6)请用合成反应流程图表示出由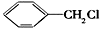 和其他无机物合成
和其他无机物合成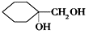 的最合理的方案(不超过4步)。例如:
的最合理的方案(不超过4步)。例如:
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三下学期冲刺模拟理综化学A卷(解析版) 题型:选择题
二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是
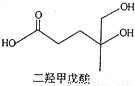
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:实验题
乙烯用途广泛,工业上可通过下列流程合成二甘醇及其衍生物。已知:R-OH+SOC12=R-C1+SO2↑+HC1↑,请回答:
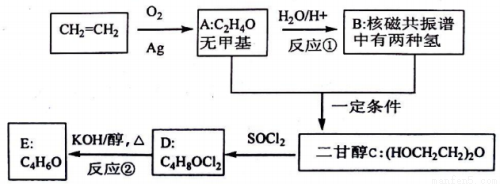
(1)写出有关物质的结构简式:A__________、D__________。
(2)指出反应类型:①__________,②__________。
(3)写出下列化学方程式:反应①__________;反应②__________。
(4)二甘醇又名(二)乙二醇醚.根据其结构判断下列说法正确的是__________(填序号)
A.难溶于水B.沸点较高C.不能燃烧D.可与金属钠反应
(5)E的同分异构体很多,指出同时符合下列条件的同分异构体的数目有__________种,
①属于链状结构②羟基不能直接连在不饱和碳原子上
③不含有“O=C=C”或“C=C=C”结构④不考虑各种立体异构
并写出其中能够发生银镜反应的所有异构体的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三第九次月考化学试卷(解析版) 题型:选择题
下列有关胶体的说法错误的是:
A.胶粒可以透过滤纸,不能透过半透膜
B.采用喷雾型药剂形成一定大小的液珠,可有效提高药物疗效
C.冶金工业的矿粒除尘利用了丁达尔效应
D.空气中的雾霾现象体现了胶体的存在
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南师大附中高一下期中化学试卷(解析版) 题型:填空题
1L某混合溶液,可能含有的离子如下表:
可能大量含有的阳离子 | H+、NH+、Al3+、K+ |
可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。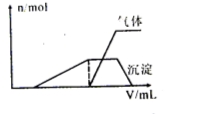
①则该溶液中一定不含有的离子是 ;
②可能存在的阳离子有 ;
③肯定不存在的阴离子是 。
(2)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向2 L该混合溶液中通入一定量的Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如表所示,分析后回答下列问题。
Cl2的体积(标准状况) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
①a的值为 ;
②当通入Cl2的体积为3.36 L(标准状态下)时,溶液中发生反应的离子方程式为 ;此时溶液中Br-、I-的物质的量浓度分别为c(Br-)= ,c(I-)= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com