
����ԭ�Ϻ췯��(�ظ����ƣ�Na2Cr2O7•2H2O)��Ҫ���Ը�����(��Ҫ�ɷ�Ϊ FeO•Cr2O3��������A12O3��SiO2 ������)Ϊ��Ҫԭ������������Ҫ�����������£�
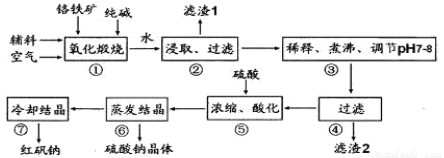
���������Ҫ��Ӧ�Ļ�ѧ����ʽΪ��4FeO•Cr2O3��8Na2CO3��7O2 =8Na2CrO4��2Fe2O3��8CO2
��1������ A12O3��SiO2�ڢ���ת����ˮ���˽�����Һ��д�� A12O3�ڢ���ת���Ļ�ѧ��Ӧ����ʽ____________________________________��
��2���û�ѧƽ���ƶ�ԭ��˵��������е�������____________(�����ӷ���ʽ�������˵��)
��3�������ữ��ʹ CrO42һת��Ϊ Cr2O72һ����1L�ữ��������Һ�к���Ԫ�ص�����Ϊ 28.6 g��CrO42-�� ת��Ϊ Cr2O72-��
ת��Ϊ Cr2O72-��
���ữ��������Һ�� c(Cr2O72- )��________
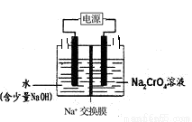
�ڹ�ҵ��Ҳ�����ͼʾװ��(������Ϊ���Ե缫)���Na2CrO4��Һ��ȡ Na2Cr2O7��ͼ���Ҳ�缫�ĵ缫��ӦʽΪ_________________________�������ǰ������Һ��������ȣ���������ת����1mol ����ʱ������Һ��������Ϊ______________g
 53���ò�ϵ�д�
53���ò�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016�����������и���4���ʼ����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ǿ�ű��Чҩ��������������ͼ��ʾ�л���Ҳ����������
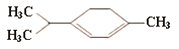
���л����һ��ȡ�����У������������칹��
A��6�� B��7�� C��8�� D��9��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�콭��ʡ������ѧ�ڿ�ǰ��ϰ��ѧ�Ծ��������棩 ���ͣ�ʵ����
�Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��(CuFeS2)ұ��ͭ�Ĺ����������£�
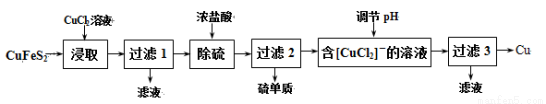
��֪��CuFeS2 + 3CuCl2��4CuCl�� + FeCl2 + 2S��
��1����ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ ��
��2��������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ ��
��3��������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽��������� ��(�����ӷ���)
��4������3������Һ�п���ѭ��ʹ�õ������� ��Ϊ�������̳���ѭ����ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ ��
��5��ұ�����ջ����Խ���ѡ��Ļ�ͭ��ɰ������ڸ��������գ�ʹ��ת��Ϊͭ����ѧ����ʽΪ��6CuFeS2+13O2 3Cu2S+2Fe3O4+9SO2 Cu2S+O2
3Cu2S+2Fe3O4+9SO2 Cu2S+O2 2Cu+SO2
2Cu+SO2
�˹�����ǰһ���������Ҫȱ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������������и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
����ѧ-ѡ��3�����ʽṹ�����ʡ�
X��Y��Z��RΪǰ������ԭ���������������Ԫ�ء�X�ĵ����������ɻ�����������G.����ˮ��ҺpH��7��Y��ԭ�����������������ڲ��������3����Z�ĵ�����һ�ֻ�ɫ���壻R��̬ԭ��3d����ĵ�������4s�����������3����
��ش��������⣺
��1��ZԪ�������ڱ��е�λ��________________���䵥�ʵľ���������________________��X��YԪ�صĵ�һ�����ܽ�С����___________(��Ԫ������)��
��2����Y�� Z�ļ��⻯���У�Y���⻯����������Ҵ�����ԭ����_____________��G��һ�������¿���CO2��Ӧ����һ������ĵ���M��M������Ԫ��ԭ�ӵ��ӻ���ʽΪ_____________��
��3�� R������Z���ʻ��ϵIJ���J�У�R���ӵĺ�������Ų�ʽ��_____________����֪J������ǿ���Ե�NaC1O��Һ��һ�������·�Ӧ������һ�־���ǿ�����Ե�R�ĺ���������÷�Ӧ�����ӷ���ʽΪ_____________��
��4�� G���ӵ����幹��Ϊ_______��R���γɻ�����R(CO)5���û�������������ѧ��������Ϊ_______��
��5�� X����Ԫ���γɵĻ�����BX���侧���ṹ��ͼ��ʾ���þ����к��е�Xԭ����ĿΪ_____________���������X��Bԭ��֮��ľ���Ϊanm��NA���������ӵ���������þ�����ܶ�Ϊ_____________g/cm
3(��ʽ��ʾ�����ػ���)��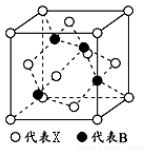
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������������и�����ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ɽ������һ��ʳƷ���Ӽ��ijɷ֣���ṹ��ͼ��ʾ������˵����ȷ����
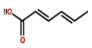
A�����л���������ʵ���Br2�����ӳɷ�Ӧʱ�����������ּӳɲ���
B�����л����������Na��NaOH��Һ��Na2CO3��Һ��NaHCO3��Һ������Ӧ
C�����л����ܷ����ӳɡ�ȡ������������ȥ���Ӿ۷�Ӧ
D����ʹ�����Ը��������Һ������л��������(2-�ǻ�����)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪:������Ũ��Ϊ0.1 mol��L -1 ��������Һ�� pH �����

�����й�˵����ȷ����
A�������ϱ���������NaClO��Һ��ͨ��CO2��CO2 + H2O+2ClO�� 2HClO + CO32-
2HClO + CO32-
B�������� NaClO��Һ��ͨHF������ǡ����ȫ��Ӧʱ��c (Na+)��c(F��)��c(HClO)
C������ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ�������˳��H2CO3��HClO��HF
D������CO2ͨ��0.1 mol��L -1 Na2CO3��Һ������Һ���ԣ�����Һ��2c(CO32��)+ c (HCO3��)= 0.1 mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڵ绯ѧ������˵����ȷ����

A����ҵ���õ��MgCl2��Һ�ķ���ұ��Mg
B����������������ʴ��������ӦʽΪ4OH��-4e���TO2��+2H2O
C����ͼ14-C�з�����Ӧ�ķ���ʽΪ��Fe��2H��=Fe2����H2��
D������п�̸ɵ�طŵ�ʱ��������ӦΪ�� MnO2��H2O��e����MnOOH��OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʯ��ɽ���и�������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ������
��������(ClO2)�ǹ�����ϵĸ�Ч�����ס����١���ȫ����ɱ��������������Ϊ����4��������������ҵ�Ͽɲ���������(NaClO3)����������(NaClO2)Ϊԭ���Ʊ�ClO2��
��1����������Ҳ��һ������������Ư��������ǿ������Һ�лᷢ���绯��Ӧ������ClO2���壬���ӷ���ʽΪ___________________________��������������Һ�м������ᣬ��Ӧ���ҡ����������Ϊ��ͬpH�����ᣬ��ʼʱ��Ӧ�������Ժ�һ��ʱ�������������Ѹ�ټӿ졣������������Ѹ�ټӿ��ԭ���� ��
��2����ѧ���ɲ��������˫��ˮ��ԭ�������Ʊ�ClO2����H2O2����ԭ���Ʊ���ClO2���ʺ���������ˮ������������Ҫԭ���� ��
��3����ⷨ��Ŀǰ�о���Ϊ���ŵ�����ClO2�ķ���֮һ����ͼ��ʾΪֱ�ӵ�������ơ��Զ���ѭ���Ʊ��ߴ�ClO2��ʵ�顣
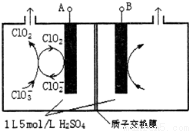
�ٵ�Դ����Ϊ___________________��(��A��B)
��д�������ҷ�����Ӧ�ĵ缫��Ӧʽ�����ӷ���ʽ
_______________________ ___ �� ��
�ۿ��Ƶ��ҺH+������5mol/L������Ч��ֹ��H+Ũ�Ƚ��Ͷ����µ�ClO2���绯��Ӧ�����������ռ�������22.4L(���������Ϊ��״�������Ե��Һ����ı仯��ClO2�����ܽ�IJ���)����ʱ��������������c(H+)֮��Ϊ_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ������ѧ�ڳ��ģ�����ۻ�ѧA���������棩 ���ͣ�ʵ����
�������ƣ�NaClO2������ҪƯ����ij��ѧ��ȤС��ͬѧչ�����������ƣ�NaClO2�����о���
ʵ�����ȡNaClO2����
��֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO2•3H2O������38��ʱ�����ľ�����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��Ba(ClO2)2������ˮ��
������ͼ��ʾװ�ý���ʵ�顣

��1��װ�â��в���ClO2����Ļ�ѧ����ʽΪ ��
��2����װ�âܷ�Ӧ�����Һ��þ���NaClO2�IJ�������Ϊ��
�ټ�ѹ��55�������ᾧ���ڳ��ȹ��ˣ��� ���ܵ���60�����õ���Ʒ�������õ��IJ��������� ��
��3�����ʵ���������NaClO2�����Ƿ�������Na2SO4�������ǣ� ��
��4����Ӧ�����ر�K2����K1��װ�âٵ������� �������ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е������� ��
ʵ��ⶨij����������Ʒ�Ĵ��ȡ�
�������ʵ�鷽����������ʵ�飺
��ȷ��ȡ��������������Ʒm g���ձ��У�������������ˮ�����ĵ⻯�ؾ��壬�ٵ���������ϡ���ᣬ��ַ�Ӧ����֪��ClO2��+ 4I��+4H+ =2H2O+2I2+Cl�����������û��Һ���100mL������Һ��
����ȡ25.00mL������Һ����ƿ�У���c mol•L-1 Na2S2O3��Һ�ζ������ζ��յ㡣�ظ�2�Σ�������ı���Һ�������ƽ��ֵΪV mL����֪��I2 +2S2O32��=2I��+S4O62������
��5���ζ���ʹ�õ�ָʾ���� ���ﵽ�ζ��յ�ʱ������Ϊ ��
��6����Ʒ��NaClO2����������Ϊ ���ú�m��c��V�Ĵ���ʽ��ʾ��ʽ����NaClO2 90.5����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com