
【题目】关于电解NaCl水溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是( )
化学式 | CH3COOH | H2CO3 | AgCl | Ag2CrO4 |
Ka或Ksp | Ka=1.8×10-5 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ksp=1.8×10-10 | Ksp=2.0×10-12 |
A. 常温下,相同浓度①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3溶液中,c(NH4+)由大到小的顺序是:①>②>③
B. AgCl 易溶于氨水难溶于水,所以AgCl 在氨水中的Ksp 大于水中的 Ksp
C. 向饱和氯水中滴加NaOH 溶液至溶液刚好为中性时,c(Na+)=2c(ClO-)+c(HClO)
D. 向浓度均为1×10-3molL-1的KCl 和K2CrO4混合液中滴加1×10-3molL-1 的AgNO3溶液,CrO42-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2-二氯乙烷的是( )
A.乙烷与氯气混合
B.乙烯与氯化氢混合
C.将乙炔通入氯的四氯化碳溶液中
D.将乙烯通入氯的四氯化碳溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(![]() )= 6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为
)= 6.0 mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为
500 mL,下列说法正确的是
A.原混合溶液中c(K+)为2 mol/L B.上述电解过程中共转移2 mol电子
C.电解得到的Cu的物质的量为0.5 mol D.电解后溶液中c(H+)为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 氧化还原反应的本质是电子的转移 B. 还原剂是在反应中得电子的物质
C. 还原剂在反应中发生还原反应 D. 置换反应不一定都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中,符合生产实际的是( )
A. 电解食盐水制得金属钠 B. 电解熔融的氧化铝制取金属铝,用铁作阳极
C. 一氧化碳高温还原铁矿石制得铁 D. 电解法精炼粗铜,用纯铜作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 ;铝与氢氧化钾溶液反应的离子方程式是 。
(2)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
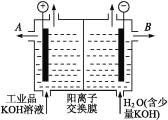
①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因 。
③除去杂质后的氢氧化钾溶液从溶液出口 (填写“A”或“B”)导出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定胆矾结晶水含量的操作中,正确的是( )
A.加热晶体时先用小火,后渐改为用大火加热至晶体变白
B.灼烧时如有晶体溅出容器,应再加一些晶体继续加热
C.加热后的冷却放在干燥器中进行
D.加热、冷却、称量,重复多次即是恒重操作
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com