
��12�֣�I�����¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol A��1.0 mol B��������ӦA(g)��B(g)  C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
C(g)��һ��ʱ���ﵽƽ�⡣�ⶨ�ò������ݼ��±���
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
�ش��������⣺
��1����Ӧǰ5 s��ƽ����Ӧ����v(A) ��____________
��2���¶�ΪTʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ����
��3�������¶ȣ�ƽ��ʱc(A)��0.41 mol��L��1����Ӧ�Ħ�H ���� ��>0�� �� ��<0����
��4����ͬ�¶��£���ʼʱ�������г���0.2 mol A��0.2 mol B��1.0 mol C����Ӧ�ﵽƽ��ǰ����Ӧ����v�� v�棨�>�� �� ��<����
��5�����д�ʩ������Ӧ���ʣ���ƽ��������Ӧ�����ƶ��� ��
a����ʱ�����A����
b���ʵ������¶�
c������B��Ũ��
d��ѡ���Ч����
II��NO��NO2�dz������������H2��CO����ԭNO�ɴﵽ������Ⱦ��Ŀ�ġ�
��֪��2NO(g) = N2(g) + O2(g) ��H = -180.5kJ��mol-1
2H2O(l) = 2H2(g) + O2(g) ��H = +571.6kJ��mol-1
����H2����ԭNO������Ⱦ���Ȼ�ѧ����ʽ��
I.��1��0.015 mol/(L��s) ��2�� 0.625
��3��< 0 ��4��< ��5��c
II. 2H2(g) + 2NO(g) = N2(g) + 2H2O(l) ��H = -752.1kJ��mol-1
��������
���������I. ��1�� ���ݱ������ݣ���Ӧ��ǰ5s��A�����ʵ����仯Ϊ0.15mol�����ݹ�ʽv=��n/V��t���㣬ƽ������V(A)=0.015 mol/(L��s)����2���ɱ������ݿ�֪����Ӧ��25s��35sʱA�����ʵ�����ȣ�˵��25sʱ�ﵽ��ƽ��״̬����
A(g)��B(g)  C(g)
C(g)
��Ӧǰ��mol�� 1.0 1.0 0
�仯��mol�� 0.2 0.2 0.2
ƽ��ʱ��mol�� 0.8 0.8 0.2
ƽ��ʱ����ֵ�Ũ��Ϊ��c��A PCl5��=c��B��= 0.8mol/2L =0.4mol/L��c��C��=0.2mol/2L=0.1mol/L��
���¶��·�Ӧ��ƽ�ⳣ��Ϊ��K=c(C3)/ c(A) ?c(B)= 0.1mol/L/(0.4mol/L)2=0.625����3������������ݷ�������Ӧ��ƽ��ʱc��A��=0.4mol/L�����������������䣬�����¶ȣ�ƽ��ʱc(A)=0��41mo1�� L-1��˵��ƽ�������ƶ��������¶�ƽ�������ȷ�Ӧ�����ƶ���������ȡ�H��0����4����ͬ�¶��£���ʼʱ�������г���0��2 mol A��0��2 mol B��1��0 mol C��Ӧ�ﵽƽ��ǰ����Ӧ������У���Ӧ����V������<V���棩����5��a�������A����,��Ӧ��Ũ�ȼ�С�������ʼ�С��������˲�䲻��Ȼ���С��ƽ�����淴Ӧ�����ƶ���b�������¶ȣ������淴Ӧ���ʶ������淴Ӧ����������࣬ƽ�����淴Ӧ�����ƶ���c������B��Ũ�ȣ���Ӧ���ʶ�����ƽ������Ӧ�����ƶ���d������ͬ�ȳ̶ȵ����������淴Ӧ���ʣ�ƽ�ⲻ�ƶ���II. ��֪�� 2NO��g��=N2��g��+O2��g����H=-180.5kJ?mol-1 ��
2H2O��l��=2H2��g��+O2��g����H=+571.6kJ?mol-1 ��
���ݸ�˹���ɣ���-�ڵ�2H2��g��+2NO��g��=N2��g��+2H2O��l����H=-752.1 kJ?mol-1
���㣺���黯ѧ��Ӧ���ʵļ��㡢��������Ի�ѧƽ���Ӱ�졢��˹���ɵȡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ�߶���ѧ���¿���ѧ���Ծ��������棩 ���ͣ�ѡ����
���������в���ȷ����
A�����ص������Ϸ���������Ӧ�������Ϸ�����ԭ��Ӧ
B�������Է����е�������ԭ��Ӧ��ͨ������ԭ��ʵ��
C�����ʱ����Ƴ�����������Ϸ���������Ӧ
D����ⱥ��ʳ��ˮʱ�������õ�����������Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ������
д������������ˮ��Һ�еĵ��뷽��ʽ��
��1��HClO__________����2��CH3COONa_________________ ����3��NH3��H2O_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
Ǧ��о����Ҫ�ɷ���ʯī���������Щ���ʰ��ղ�ͬ�ı������Ի�͡�ѹ�ƣ��Ϳ����Ƴ�Ǧ��о�����Ǧ��о������һ��ɷ���ʯī������Ǧ��дһ�������ĵ�����ԼΪ1mg����ôһ��Ǧ���ֺ��е�̼ԭ����ԼΪ
A��2��5��1022�� B��2��5��1019��
C��5��1022�� D��5��1019��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�����ʡ��һ��ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������д������
A������������ͭ�ֽ�������ͭʱ��Ҫ���ȱ��ò���������
B����ҩ����ֽ�۰ѷ�ĩ״ҩƷ�����Թܵĵײ�
C������ʱ��������ĩ��Ӧ������������ֽ��
D�����û���ԹܼУ�������ʱ�ֳ��Թܸ������Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ��������У�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾΪ800 �� ʱA��B��C�����������ܱ������з�ӦʱŨ�ȵı仯��ֻ����ͼ�β��ܵó��Ľ�����

A��A�Ƿ�Ӧ��
B��ǰ2 min A�ķֽ�����Ϊ0.1 mol��L��1��min��1
C����ƽ����������¶ȣ�ƽ��������Ӧ�����ƶ�
D����Ӧ�ķ���ʽΪ��2A(g)  2B(g) ��C(g)
2B(g) ��C(g)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ�긣��ʡ��������У�߶���ѧ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪��H2(g)��F2(g)===2HF(g) �������仯��ͼ��ʾ�������й���������ȷ����
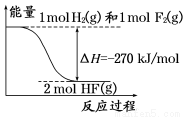
A������������ֽ����������ͷ����ķ�Ӧ�Ƿ��ȷ�Ӧ
B��1 mol H2��1 mol F2��Ӧ����2 molҺ̬HF�ų�������С��270 kJ
C������ͬ�����£�1 mol H2��1 mol F2�������ܺʹ���2 mol HF���������
D������1 mol H��H����1 mol F��F ���ų������������γ�2 mol H��F���ų�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����������ײʱ����ȫ�����з�����Ӧ10NaN3+2KNO3 = K2O+5Na2O+16N2��������������Ȼ�ԭ�����1.75 mol���������жϴ������
A����0��250 mol KNO3������
B������44.8 L N2����״����
C��ת�Ƶ��ӵ����ʵ���Ϊ1.25 mol
D����������Nԭ�ӵ����ʵ���Ϊ3.75 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ��㶫ʡ��ͷ�и�����ѧ���������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
������ʵ��װ�ý��е�ʵ���У����ܴﵽ��Ӧʵ��Ŀ�ĵ���

A����ͼ����ʾʵ��װ���ſ������ռ�H2����
B��ͼ��װ�ÿ���������֤��ѧ��ת��Ϊ����
C��ͼ����Ƭ������ȫ�ܽ⣬�Ҹ��������Һ��ɫ
D��ͼ����ʾʵ��ɱȽ���̼��������Ԫ�صķǽ�����ǿ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com