
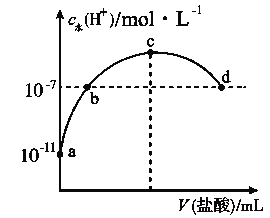
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
【答案】B
【解析】
A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=1014/1011mol/L=0.001mol/L,结合Kb=c(NH4+)c(OH)/c(NH3H2O)计算;
B.a、b之间的任意一点,溶液都呈碱性,结合电荷守恒判断离子浓度大小;
C.根据图知,c点水电离出的氢离子浓度最大,恰好反应生成氯化铵;
D. b点溶液中c点水电离出的c(H+)=10-7mol/L,常温下c(H+)·c(OH-)=Kw=10-14,据此判断。
A.常温下,0.1mol/L的氨水溶液中c(H+)=10-11mol/L,则c(OH-)=1014/1011mol/L=0.001mol/L,Kb=c(NH4+)c(OH)/c(NH3H2O)=103×103/0.1mol/L=1×10-5mol/L,故A正确;
B.a、b之间的任意一点,溶液都呈碱性,则c(H+)<c(OH-),结合电荷守恒得c(Cl-)<c(NH4+),而c(Cl-)和c(OH-)的相对大小与所加盐酸的量有关,故B错误;
C.根据图知,c点水电离出的氢离子浓度最大,恰好反应生成氯化铵,铵根水解溶液呈酸性,结合电荷守恒得:c(NH4+)<c(Cl-),故C正确;
D.b点溶液中c(H+)=10-7mol/L,常温下c(H+)·c(OH-)=Kw=10-14,所以c(H+)=c(OH-),溶液呈中性,故D正确。
故选B。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿的主要成分是FeWO4、MnWO4,还含有少量Si、P、As的化合物。由黑钨矿制备WO3的工艺流程如图:
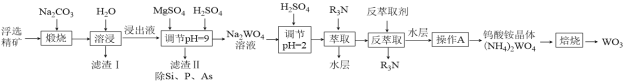
已知:①滤渣I的主要成份是Fe2O3、Mn3O4。
②萃取剂为叔胺N235,化学式用R3N表示,是一种弱碱。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价是_________,“煅烧”过程中生成Mn3O4的化学方程式是________________________________________________。
(2)溶浸时,固体要进行粉碎,同时还要不断搅拌的目的是______________________________。
(3)浸出液中的溶质有Na2WO4、Na2SiO3、Na3PO4、Na3AsO4,加入MgSO4、H2SO4将溶液的pH调至9时,溶液中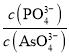 =_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
=_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
(4)“调节pH=2”时,钨酸钠(Na2WO4)转化为偏钨酸钠(Na6H2W12O40)的离子方程式是
12WO42-+ 18H+![]() H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)
H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
(R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
A.氨水 B.NaOH溶液 C.NH4HCO3溶液 D.NH4Cl溶液
(5)操作A的名称是__________,焙烧生成WO3的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红磷(P)和Cl2发生反应生成PCl3和PCl5,反应过程和能量的关系如图所示,图中的ΔH表示生成1 mol产物的数据。可知PCl5分解生成PCl3和Cl2,该分解反应是可逆反应。下列说法正确的是

A. 其他条件不变,升高温度有利于PCl5的生成
B. 反应2P(s)+5Cl2(g)===2PCl5(g)对应的反应热 ΔH=-798 kJ·mol-1
C. P和Cl2反应生成PCl3的热化学方程式为:2P(s)+3Cl2(g)===2PCl3(g)ΔH=-306 kJ·mol-1
D. 其它条件不变,对于2PCl5(g)===2P(s)+5Cl2(g) ΔH反应,增大压强,PCl5的转化率减小,ΔH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。m、n、r为这些元素组成的化合物,常温下,0.1 mol·L-1 m溶液的pH=13,组成n的两种离子的电子层数相差1。p、q为其中两种元素形成的单质。上述物质的转化关系如图所示。下列说法正确的是 ( )
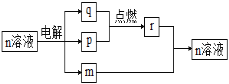
A. 原子半径:X<Y<Z<W
B. X、Z既不同周期也不同主族
C. 简单氢化物的沸点:Y<W
D. Y、Z、W形成的一种化合物具有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用足量的浓盐酸与一定量的高锰酸钾反应(不加热),来制取氯气。
反应:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
(1)“双线桥法”标出电子转移情况________。
(2)若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
①理论上需要多少克KMnO4参加反应?________。
②被氧化的HCl的物质的量为多少?________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“循环经济”和“低碳经济”是目前备受关注的课题,因而对碳和硫的化合物的综合利用成为研究的热点。请回答下列问题:
(1)下列事实中,不能用来比较碳元素和硫元素非金属性强弱的是______(填选项字母)。
A.![]() 有漂白性而
有漂白性而![]() 没有
没有
B.少量![]() 能与
能与![]() 反应生成
反应生成![]()
C.![]() 能使酸性
能使酸性![]() 溶液褪色而
溶液褪色而![]() 不能
不能
D.![]() 溶液显碱性而
溶液显碱性而![]() 溶液显中性
溶液显中性
(2)下图是通过热循环进行能源的综合利用和污染治理的反应系统原理。

系统(Ⅱ)制氢气的热化学方程式为_________;两个系统制得等量的H2所需能量较少的是________。
(3)向10 L恒容密闭容器中充入2 mol CO和1 mol ![]() ,发生反应2CO(g)+SO2 (g)
,发生反应2CO(g)+SO2 (g)![]() S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
S(g)+2CO2 (g)。CO和CO2的平衡体积分数(φ)与温度(T)的关系如图所示。
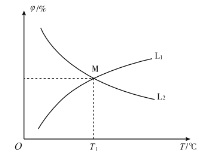
①图中能表示CO的平衡体积分数与温度关系的曲线为______(填“L1”或“L2”)。
②T1 ℃时,![]() 的平衡转化率α1=_______,反应的平衡常数
的平衡转化率α1=_______,反应的平衡常数![]() _________。
_________。
③只改变下列条件,既能加快该反应速率,又能增大CO的平衡转化率的是_____(填选项字母)。
A.增大压强 B.充入一定量![]()
C. 充入一定量![]() D.加入适当催化剂
D.加入适当催化剂
④向起始温度为![]() ℃的10 L绝热容器中充入2 mol CO和1 mol
℃的10 L绝热容器中充入2 mol CO和1 mol ![]() ,重复实验,该反应的平衡常数
,重复实验,该反应的平衡常数![]() _____
_____![]() (填“>”“<”或“=”),理由为_____。
(填“>”“<”或“=”),理由为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅹ、Y、Z、W、M五种元素的原子序数依次增大。已知Ⅹ、Y、Z、W是短周期元素中的四种非金属元素,X元素的原子形成的离子就是一个质子;Y原子的最外层电子数是内层电子数的2倍;Z、W在元素周期表中处于相邻的位置,它们的单质在常温下均为无色气体;M是地壳中含量最高的金属元素。下列说法正确的是
A. 原子半径:r(M)>r(Y)>r(Z)>r(W)>r(X)
B. W和M形成的化合物不能与强碱反应
C. Ⅹ、Z、W三元素所形成的化合物一定为共价化合物
D. Y、Z的最高价含氧酸的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物K是某药物的前体,合成路线如图所示:
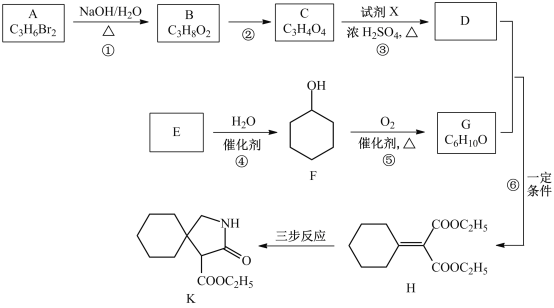
已知:R-CN![]()
![]() ;
;
![]()
![]() +
+![]()
(1)A的名称是_____________。
(2)反应①的化学方程式是___________________。
(3)反应②的类型是__________________。
(4)反应③中的试剂X是________________。
(5)E属于烃,其结构简式是_________________。
(6)H中所含的官能团是_________________。
(7)反应⑥的化学方程式是_____________________。
(8)H经三步反应合成K,写出中间产物I和J的结构简式______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:

下列说法不正确的是
A. b为电源的正极
B. ①②中,捕获CO2时碳元素的化合价发生了变化
C. a极的电极反应式为2C2O52 4e == 4CO2 + O2
D. 上述装置存在反应:CO2 ===== C + O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com