
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿的主要成分是FeWO4、MnWO4,还含有少量Si、P、As的化合物。由黑钨矿制备WO3的工艺流程如图:
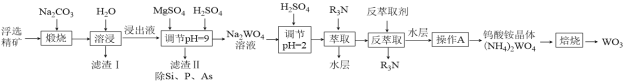
已知:①滤渣I的主要成份是Fe2O3、Mn3O4。
②萃取剂为叔胺N235,化学式用R3N表示,是一种弱碱。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价是_________,“煅烧”过程中生成Mn3O4的化学方程式是________________________________________________。
(2)溶浸时,固体要进行粉碎,同时还要不断搅拌的目的是______________________________。
(3)浸出液中的溶质有Na2WO4、Na2SiO3、Na3PO4、Na3AsO4,加入MgSO4、H2SO4将溶液的pH调至9时,溶液中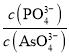 =_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
=_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
(4)“调节pH=2”时,钨酸钠(Na2WO4)转化为偏钨酸钠(Na6H2W12O40)的离子方程式是
12WO42-+ 18H+![]() H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)
H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
(R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
A.氨水 B.NaOH溶液 C.NH4HCO3溶液 D.NH4Cl溶液
(5)操作A的名称是__________,焙烧生成WO3的化学方程式是_______________________。
【答案】+6 6MnWO4 + 6Na2CO3 + O2![]() 6Na2WO4 + 2Mn3O4 + 6CO2 增大固体与水的接触面积,加快溶解速率,使固体充分溶解,提高原料的利用率 10-2 AC 蒸发浓缩、冷却结晶、过滤洗涤(干燥) (NH4)2WO4
6Na2WO4 + 2Mn3O4 + 6CO2 增大固体与水的接触面积,加快溶解速率,使固体充分溶解,提高原料的利用率 10-2 AC 蒸发浓缩、冷却结晶、过滤洗涤(干燥) (NH4)2WO4![]() WO3+2NH3↑+H2O
WO3+2NH3↑+H2O
【解析】
由黑钨矿冶炼钨的工艺流程:向黑钨矿中[主要成分是铁和锰的钨酸盐(FeWO4、MnWO4)],还含少量Si、P、As的化合物)中加入Na2CO3,在空气中煅烧,主要反应为:6MnWO4 + 6Na2CO3 + O2![]() 6Na2WO4 + 2Mn3O4 + 6CO2、4FeWO4 + 4Na2CO3 + O2
6Na2WO4 + 2Mn3O4 + 6CO2、4FeWO4 + 4Na2CO3 + O2![]() 4Na2WO4 + 2Fe2O3+ 4CO2,加水溶解后再过滤,所得滤渣I的主要成份是不溶于水的Fe2O3和Mn3O4,滤液中除Na2WO4 外,还含有少量Na2SiO3、Na3PO4、Na3AsO4,向滤液中加入MgSO4溶液,并滴加稀硫酸调节溶液pH=9左右,除去不溶物,得到含有MgSiO3、MgHPO4、MgHAsO4的滤渣Ⅱ,滤液主要是含Na2WO4的溶液,再加入稀硫酸调节pH=2并依次用R3N萃取除去水层后,再加入反萃取剂获得(NH4)2WO4的水溶液,经蒸发浓缩、冷却结晶、过滤洗涤(干燥)即可得到(NH4)2WO4晶体,最后将所得晶体焙烧即得到WO3,据此分析解题。
4Na2WO4 + 2Fe2O3+ 4CO2,加水溶解后再过滤,所得滤渣I的主要成份是不溶于水的Fe2O3和Mn3O4,滤液中除Na2WO4 外,还含有少量Na2SiO3、Na3PO4、Na3AsO4,向滤液中加入MgSO4溶液,并滴加稀硫酸调节溶液pH=9左右,除去不溶物,得到含有MgSiO3、MgHPO4、MgHAsO4的滤渣Ⅱ,滤液主要是含Na2WO4的溶液,再加入稀硫酸调节pH=2并依次用R3N萃取除去水层后,再加入反萃取剂获得(NH4)2WO4的水溶液,经蒸发浓缩、冷却结晶、过滤洗涤(干燥)即可得到(NH4)2WO4晶体,最后将所得晶体焙烧即得到WO3,据此分析解题。
(1)钨酸盐(FeWO4、MnWO4)中Fe或Mn元素的化合价均为+2价,氧元素的化合价为-2价,设W元素化合价为x,则(+2)+(x)+(-2)×4=0,解得钨元素的化合价是+6价;“煅烧”过程中MnWO4和Na2CO3、O2在高温下反应生成Mn3O4,由质量守恒可知还有Na2WO4、CO2生成,发生反应的化学方程式是6MnWO4 + 6Na2CO3 + O2![]() 6Na2WO4 + 2Mn3O4 + 6CO2;
6Na2WO4 + 2Mn3O4 + 6CO2;
(2)溶浸时,为增大固体与水的接触面积,加快溶解速率,使固体充分溶解,提高原料的利用率,应将固体进行粉碎,并用玻璃棒不断搅拌;
(3)已知Ksp[Mg3(PO4)2]=c3(Mg2+)×c2(PO43-)=2.0×10-24、Ksp[Mg3(AsO4)2] =c3(Mg2+)×c2(AsO43-)=2.0×10-20,将溶液的pH调至9时,溶液中![]() =
=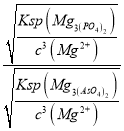 =
=![]() =10-2;
=10-2;
(4)加入反萃取剂的目的获得(NH4)2WO4溶液,即使3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层)平衡逆向移动,则应选择氨水或NH4HCO3溶液;不选择NaOH溶液,因其会引入杂质离子Na+;不选择NH4Cl溶液,因其会引入杂质离子Cl-,且不影响平衡的移动,故答案为AC;
(R3NH)6H2W12O40(油层)+ 3SO42-(水层)平衡逆向移动,则应选择氨水或NH4HCO3溶液;不选择NaOH溶液,因其会引入杂质离子Na+;不选择NH4Cl溶液,因其会引入杂质离子Cl-,且不影响平衡的移动,故答案为AC;
(5)操作A是指将(NH4)2WO4的水溶液经蒸发浓缩、冷却结晶、过滤洗涤(干燥)得到(NH4)2WO4晶体;(NH4)2WO4晶体焙烧生成WO3,同时得到NH3和水,发生反应的化学方程式是(NH4)2WO4![]() WO3+2NH3↑+H2O。
WO3+2NH3↑+H2O。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】乙酸分子的结构式为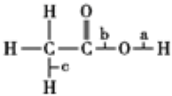 ,下列反应及断键部位正确的是
,下列反应及断键部位正确的是
①乙酸的电离,是a键断裂
②乙酸与乙醇发生酯化反应,是b键断裂
③在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2![]() CH2Br—COOH+HBr,是c键断裂
CH2Br—COOH+HBr,是c键断裂
④乙酸变成乙酸酐的反应:2CH3COOH ![]()
![]() +H2O,是a、b键断裂
+H2O,是a、b键断裂
A. 仅①②③ B. ①②③④ C. 仅②③④ D. 仅①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家构建了一种有机框架物M,结构如图。下列说法错误的是( )
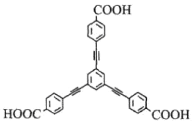
A. 1molM可与足量Na2CO3溶液反应生成1.5molCO2
B. 苯环上的一氯化物有3种
C. 所有碳原子均处同一平面
D. 1molM可与15mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Al3+的水解方程式:![]()
C. 钢铁发生电化学腐蚀的正极反应:Fe-2e-=Fe2+
D. 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A和C为原料合成治疗多发性硬化症药物H的路线如下:
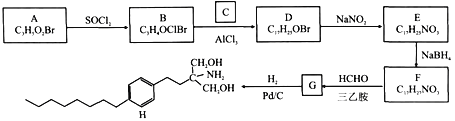
已知:
①A能与NaHCO3溶液反应放出CO2,其核磁共振氢谱显示有三组峰,峰面积比为2:2:1。
②NaBH4能选择性还原醛、酮,而不还原—NO2。

回答下列问题:
(1)A的化学名称为________,D的结构简式为_______。
(2)H的分子式为_______,E中官能团的名称为_______。
(3)B→D、E→F的反应类型分别为_______。
(4)F→G的化学方程式为________。
(5)与C互为同分异构体的有机物的结构简式为_______(核磁共振氢谱为四组峰,峰面积比为6:3:1:1)。
(6)设计由B和![]() 为原料制备具有抗肿瘤活性药物
为原料制备具有抗肿瘤活性药物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入1 mol·L-1的H2SO4溶液中,乙同学将电极放入1mol·L-1的NaOH溶液中,如图所示。

①写出甲中负极的电极反应式:__________。
②乙中负极反应式为__________,总反应的离子方程式:_______。
(2)将用导线相连的两个铂电极插入KOH溶液中,然后向两极分别通入CH3OH(甲醇)和O2 ,则发生了原电池反应,该原电池中的负极反应式为________________;正极反应式为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列实验装置图,按要求作答:

(1)写出图中四种实验操作的名称:___________________________________________________。
(2)装置④中所有玻璃仪器的名称:____________,____________。
(3)下列实验需要在哪套装置中进行:(填序号,每套装置仅使用一次)
A从海水中获取蒸馏水____________;B从KCl溶液中获取KCl晶体____________;
C分离CaCO3和水____________;D分离植物油和水____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O3(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A. △H1>0,△H3<0
B. △H2>0,△H4>0
C. △H1=△H2+△H3
D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L-1氨水中滴加一定浓度的稀盐酸,溶液中由水电离的氢离子浓度随加入盐酸体积的变化如图所示。则下列说法不正确的是( )
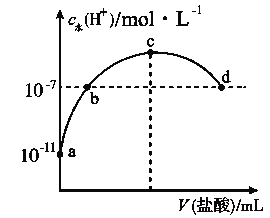
A. 常温下,0.1 mol·L-1氨水中![]() 的电离常数
的电离常数![]() 约为
约为![]()
B. a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C. c点溶液中c(NH4+)<c(Cl-)
D. b点代表溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com