
【题目】化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A. HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Al3+的水解方程式:![]()
C. 钢铁发生电化学腐蚀的正极反应:Fe-2e-=Fe2+
D. 氢氧燃料电池的负极反应式:O2+2H2O+4e-=4OH-
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是
![]()
A. X的气态氢化物比Y的稳定
B. W的最高价氧化物对应水化物的酸性比Z的强
C. Z的非金属性比Y的强
D. X与Y形成的化合物都易溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I. 分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________.
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为__________,该物质的分子式是__________.
(3)根据价键理论,预测A的可能结构并写出结构简式__________.
II.结构式的确定:
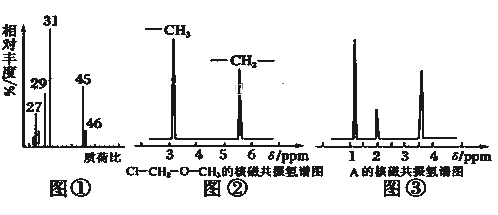
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl﹣CH2﹣O﹣CH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,II代表HAˉ,III代表A2ˉ)。根据如图图示判断,下列说法正确的是
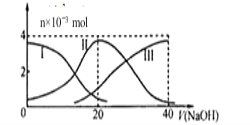
A. 当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(A2ˉ)>c(H+)>c(HAˉ)>c(OHˉ)
B. 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水的大
C. 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+3c(H2A)+c(HAˉ)= c(A2ˉ)+2c(OHˉ)
D. 向NaHA溶液加入水的过程中,pH可能增大也可能减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能含有以下离子中的几种:Na+、K+、NH4+、Ag+、Mg2+、Cu2+、Cl-、CO32-、SO42-且所含的各离子物质的量浓度相等;取三份进行如下实验:
①向第一份中加入足量BaCl2溶液,得到白色沉淀,过滤后用盐酸洗涤沉淀,结果沉淀消失
②向第二份加入足量硝酸酸化的AgNO3溶液,溶液出现白色沉淀
③向第三份加入足量NaOH溶液并加热,收集到一定体积的气体,但溶液依然澄清
试回答下列问题:
(1)肯定存在的离子有______________________
(2)写出①中发生的离子反应方程式________________,___________________
(3)写出②中发生的离子反应方程式________________,___________________
(4)写出③中发生的离子反应方程式_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期元素。n、p、r是由这些元素组成的二元化合物。m 是元素W的单质。q是元素Y的单质且是制作太阳能电池的原料。p在常温下为常见无色液体,0.010mol·L-1的r溶液中c(H+)为0.010 mol·L-1,s是弱酸且不溶于水。上述物质的转化关系如图所示。下列说法不正确的是

A.r易溶于p
B.原子半径:Z<Y
C.最高价氧化物对应水化物的酸性:Y<Z
D.最简单氢化物的稳定性:X<Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿的主要成分是FeWO4、MnWO4,还含有少量Si、P、As的化合物。由黑钨矿制备WO3的工艺流程如图:
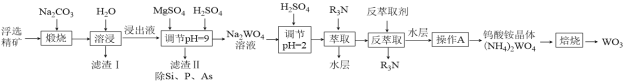
已知:①滤渣I的主要成份是Fe2O3、Mn3O4。
②萃取剂为叔胺N235,化学式用R3N表示,是一种弱碱。
回答下列问题:
(1)钨酸盐(FeWO4、MnWO4)中钨元素的化合价是_________,“煅烧”过程中生成Mn3O4的化学方程式是________________________________________________。
(2)溶浸时,固体要进行粉碎,同时还要不断搅拌的目的是______________________________。
(3)浸出液中的溶质有Na2WO4、Na2SiO3、Na3PO4、Na3AsO4,加入MgSO4、H2SO4将溶液的pH调至9时,溶液中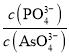 =_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
=_________。已知Ksp[Mg3(PO4)2]=2.0×10-24、Ksp[Mg3(AsO4)2] =2.0×10-20。
(4)“调节pH=2”时,钨酸钠(Na2WO4)转化为偏钨酸钠(Na6H2W12O40)的离子方程式是
12WO42-+ 18H+![]() H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)
H2W12O406-+ 8H2O。萃取过程发生反应是3(R3NH)2SO4(油层)+ H2W12O406-(水层)![]() (R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
(R3NH)6H2W12O40(油层)+ 3SO42-(水层),则反萃取获得(NH4)2WO4溶液时的反萃取剂可选择________。
A.氨水 B.NaOH溶液 C.NH4HCO3溶液 D.NH4Cl溶液
(5)操作A的名称是__________,焙烧生成WO3的化学方程式是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由甲醇![]() 、氧气和
、氧气和![]() 溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
溶液构成的新型手机电池,可使手机连续使用一个月才充一次电。
(1)写出该电池负极电极反应式______
(2)若以该电池为电源,用石墨作电极电解含有如下离子的溶液。
离子 |
|
|
|
|
|
|
|
|
|
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上发生的电极反应为______;阴极收集到的气体体积为(标准状况)______。
(3)若用该电池做电源,用石墨做电极电解硫酸铜溶液,当电路中转移![]() 时,实际上消耗的甲醇的质量比理论上大,可能原因是______。
时,实际上消耗的甲醇的质量比理论上大,可能原因是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。m、n、r为这些元素组成的化合物,常温下,0.1 mol·L-1 m溶液的pH=13,组成n的两种离子的电子层数相差1。p、q为其中两种元素形成的单质。上述物质的转化关系如图所示。下列说法正确的是 ( )
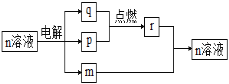
A. 原子半径:X<Y<Z<W
B. X、Z既不同周期也不同主族
C. 简单氢化物的沸点:Y<W
D. Y、Z、W形成的一种化合物具有漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com