
| A.盐酸 | B.Na2CO3溶液 |
| C.氯水 | D.FeCl3溶液 |
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl 溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| C | 向一定浓度的Na2SiO3溶液中通入适量CO2气体 | 出现白色沉淀 | H2SiO3的酸性比H2CO3的酸性强 |
| D | 向浓度均为0. 1 mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.图1制备并收集少量NO2气体 |
| B.图2是原电池装置,Fe电极为负极 |
| C.图3常用于分离互不相溶的液体 |
| D.图4可用于实验室制取和收集乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
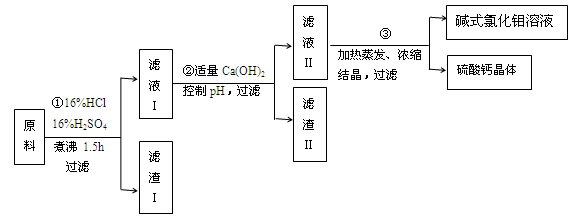
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在纸上层析操作时,要让试样点刚好接触展开剂,否则不能很好地分离。 |
| B.实验室制备硝基苯时,先将浓硫酸滴入浓硝酸后,冷却,再边振荡边滴加苯。 |
| C.从海带中提取碘的方法是:取样→灼烧→溶解→过滤→萃取。 |
| D.向盛有少量Na2O2的试管中加入少量水,并立即滴入2滴酚酞,振荡,溶液呈红色。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

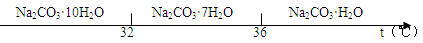
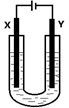
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.实验室制氢气,为了加快反应速率,可向稀H2SO4中滴加少量Cu(NO3)2溶液 |
| B.氨基酸是人体必需的营养物质,其晶体主要以内盐形式存在,调节溶液的pH可改变它的溶解度 |
| C.在苯酚和乙醇性质比较实验中,将等物质的量的乙醇和苯酚置于试管中,再投入金属钠,从而可以比较出羟基氢的活泼性 |
| D.抽滤完毕,直接用玻璃棒刮下布氏漏斗中滤纸上的固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com