
 N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表:
N2(g)+CO2(g) 。某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如右表: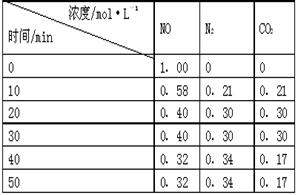
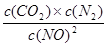 , (1分) K=0.56 (2分)
, (1分) K=0.56 (2分)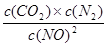 =
= 。
。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:不详 题型:实验题
 HCOOH + CH3OH – Q(Q>0)
HCOOH + CH3OH – Q(Q>0)| 组分 | 物质的量/mol |
| HCOOCH3 | 1.00 |
| H2O | 1.99 |
| HCOOH | 0.01 |
| CH3OH | 0.52 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间(s) C(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | a | 0.10 | c | d | e |
| C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.研制高温下活性较大的催化剂 |
| B.寻求氮气的新来源 |
| C.研制低温下活性较大的催化剂 |
| D.研制耐高温和高压的新材料建造合成塔 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C.则下列说法中正确的是( )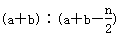
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
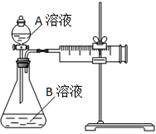
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
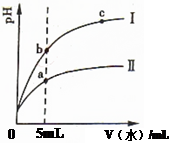
| A.Ⅰ为醋酸稀释时pH变化曲线 |
| B.溶液的导电性:b>a>c |
| C.取“0”处等体积的两者溶液分别加足量铁粉,放出H2的量:醋酸>盐酸 |
| D.取5mL处等体积两者溶液分别与相同的Zn粒反应,开始时的反应速率:Ⅰ>Ⅱ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法,| A.①③ | B.①④ | C.②③ | D.③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com