
【题目】根据所学知识,回答问题:
Ⅰ.在第三周期元素及其单质和化合物中,氧化性最强的单质是__________,还原性最强的单质是__________;最高价氧化物对应的水化物中,最强的酸是__________,最强的碱是_________,形成的两性氢氧化物是__________;化学性质最稳定的元素是__________。
Ⅱ.(1)A元素原子的核电荷数为8,其原子核内的质子数为__________,该元素原子的二价阴离子的核外电子数为_________,中子数是8的核素表示为__________。
(2)B元素原子的一价阳离子的核外有10个电子,质量数为23,该元素原子的原子核内中子数为__________。
(3)A、B形成1:1型化合物的相对分子质量是__________。
【答案】Cl2 Na HCIO4 NaOH Al(OH)3 Ar 8 10 ![]() 12 78
12 78
【解析】
I.同一周期的元素,从左到右元素的金属性逐渐减弱,非金属性逐渐增强。元素的金属性越强,单质的还原性越强,最高价氧化物对应的水化物的碱性越强;元素的非金属性越强,其单质的氧化性越强,最高价含氧酸的酸性越强;处于金属与非金属交界处的Al的氢氧化物显两性;惰性气体原子达到最外层8个(He为2个)电子的稳定结构;
II.8号元素是O,原子最外层有6个电子,容易获得2个电子变为O2-,达到最外层8个电子稳定结构;根据原子核外电子数等于原子核内质子数等于原子序数分析;原子获得电子形成阴离子,原子失去电子形成阳离子,质量数等于原子核内质子数与中子数的和,B一价阳离子的核外有10个电子,则B是Na元素,二者1:1形成的化合物是Na2O2,该物质是离子化合物。
I.由于同一周期的元素,从左到右元素的金属性逐渐减弱,非金属性逐渐增强,所以在第三周期元素及其单质和化合物中,氧化性最强的单质是Cl2,还原性最强的单质是Na;元素的金属性越强,最高价氧化物对应的水化物的碱性越强;元素的非金属性越强,最高价含氧酸的酸性越强,所以最高价氧化物对应的水化物中,最强的酸是HCIO4,最强的碱是NaOH,处于金属与非金属交界处的Al的氢氧化物显两性,则形成的两性氢氧化物是Al(OH)3;处于元素周期表每一周期最后的惰性气体元素的原子达到最外层8个(He为2个)电子的稳定结构,所以第三周期元素中,化学性质最稳定的元素是Ar。
Ⅱ.(1)A元素原子的核电荷数为8,该元素是O元素,原子核内的质子数为8,核外电子排布是2、6,最外层有6个电子,容易获得2个电子,达到最外层8个电子的稳定结构,形成O2-,该元素原子的二价阴离子的核外电子数为10,中子数是8的核素表示为![]() ;
;
(2)B元素原子的一价阳离子的核外有10个电子,说明原子失去1个电子后有10个电子,因此B元素是11号Na元素,质量数为23,该元素原子的原子核内中子数为23-11=12;
(3)A、B形成1:1型化合物是Na2O2,其相对分子质量是23×2+16×2=78。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25℃) | Ka = 1.8×10-5 | Ka=4.3×l0-10 | Ka1=5.0×l0-7 Ka2=5.6×l0-11 |
① 0.1 moI/L NaCN溶液和0.1mol/L NaHCO3溶液中,c(CN-)______c(HCO3-)(填“>”、“<”或“=”)。
②常温下,pH相同的三种溶液:A.CH3COONa B.NaCN C.Na2CO3,其物质的量浓度由大到小的顺序是________(填编号)。
③已知25℃时,CH3COOH(aq)+OH-( aq)=CH3COO-(aq) +H2O △H=-akJ/mol,H+(aq) +OH-(aq) =H2O △H=-b kJ/mol,醋酸电离的热化学方程式为________________。
④将少量CO2通入NaCN溶液,反应的离子方程式是____________________________。
⑤室温下,-定浓度的CH3COONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是______________,溶液中c(CH3COO-)/c(CH3COOH) =___________。
(2)室温下,用0.100 mol/L盐酸溶液滴定20.00mL0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
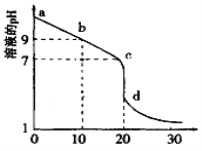
① d点所示的溶液中离子浓度由大到小的顺序依次为____________。
② b点所示的溶液中c(NH3·H2O)-c(NH4+)=_________(用溶液中的其它离子浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.195g锌粉加入到20.0mL的0.100mol/L的MO2+溶液中,恰好完全反应,则还原产物可能是
A. M2+ B. M C. MO2+ D. M3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将一定量的气体通入体积为2L的密闭容器中,使其发生反应,,有关物质X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )

A. 该反应的化学方程式为: 3Z = 3X+2Y
B. t0时,X、Y、Z的质量不再改变
C. t0时,Z的浓度为1.2 mol/L
D. t0时,反应停止,反应速率为0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化学专家侯德榜(下图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
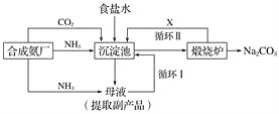

(1)上述生产纯碱的方法称__________,副产品的一种用途为______________。
(2)沉淀池中发生的化学反应方程式是______________。
(3)写出上述流程中X物质的分子式______________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作是________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
(1)实验室制氯气的化学方程式:________________________,此反应的氧化剂为:_____________ ;还原剂为:_____________;氧化剂与还原剂物质的量之比为:______________;
(2)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,写出化学反应方程式,并画出双线桥,标出电子转移的方向和数目:__________________________________。
(3)漂白粉的有效成分是________________________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜、氯化亚铜是重要的化工原料,广泛地用作有机合成催化剂。
I.实验室中以粗铜(含杂质Fe)为原料制备铜的氯化物。现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹、酒精灯已省略)。按要求回答下列问题:
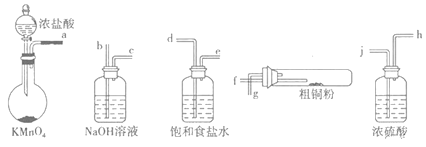
(1)按气流方向连接各仪器接口顺序是:a![]() ______________________________。
______________________________。
(2)写出加热时硬质试管中发生化学反应的方程式是______________________________。
(3)反应后,盛有NaOH溶液的广口瓶中溶液具有漂白、消毒作用,若用钢铁(含Fe、C)制品盛装该溶液会发生电化腐蚀,钢铁制品表面生成红褐色沉淀,溶液会失去漂白、杀菌消毒功效。该电化腐蚀过程中正极反应式是_______________________________。
II.将上述实验制得的固体产物按如下流程操作,试回答下列问题:
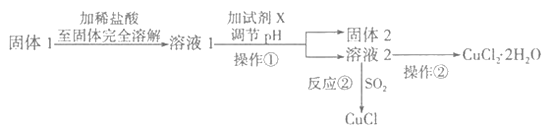
(1)检验溶液2中是否含有杂质离子的试剂是__________________。
(2)某同学用实验制得的CuCl2·2H2O晶体配制500mL0.1 mol·L-1的CuCl2溶液,在称量出CuCl2·2H2O晶体后,溶解该晶体的具体操作为_________________________________,分析以下操作对配制的溶液浓度造成的影响,影响偏高的是___________________________。
①蒸馏水洗完容量瓶后没有烘干 ②转移溶液过程中出现漏液
③砝码生锈 ④定容时俯视
(3)溶液l可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)_________。
a.NaOH b.NH3·H2O c.CuO d.CuSO4 e.Cu2(OH)2CO3
(4)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式:_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com