
【题目】环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O2![]() 3CO2+4H2O。下列说法中不正确的是
3CO2+4H2O。下列说法中不正确的是
A.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.燃烧时化学能只转化为热能
【答案】D
【解析】
一个化学反应是放热反应还是吸热反应,取决于反应物和生成物所具有的总能量的相对大小,所有的燃烧反应都是放热反应,丙烷燃烧产物为二氧化碳和水,对环境无污染。
A. 丙烷完全燃烧方程式为:C3H8+5O2![]() 3CO2+4H2O,产物二氧化碳和水,对环境无污染,因此丙烷为环保型燃料,A正确;
3CO2+4H2O,产物二氧化碳和水,对环境无污染,因此丙烷为环保型燃料,A正确;
B. 燃烧反应是指物质中的可燃性成分与氧气剧烈反应形成火焰,放出大量的热和产生强烈光的过程,所有的燃烧反应都是放热反应,B正确;
C. 根据能量守恒定律,如果反应物所具有的总能量高于生成物所具有的总能量,在反应中有一部分能量转变为热能的形式释放,这样的反应是放热反应。所有的燃烧反应都是放热反应,丙烷的燃烧是放热反应,所以1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量,C正确;
D. 火炬燃烧时,不仅发热,而且发光,而且反应产物中也含有一定的化学能。所以火炬燃烧时,化学能不仅转化为热能,还转化为光能等其它形式的能。D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】在2A+B ![]() 3C+4D反应中,表示该反应速率最快的是
3C+4D反应中,表示该反应速率最快的是
A. v(A)=0.5mol·L-1· s-1B. v(B)=0.3 mol·L-1· s-1
C. v(C)=0.8 mol·L-1· s-1D. v(D)=10 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物D对花香和果香的香味具有提升作用,故常用于化妆品工业和食品工业。有机物D可以用下面的设计方案合成。

(1)A的结构简式______,C的名称____,该流程中涉及到的共同的反应类型有____,D中的官能团的名称为_____。
(2)写出下列反应的化学方程式:
②__________________
③_________________
(3)芳香族化合物E的分子式与C相同,写出E可能结构的结构简式(可不填满):___、___、_____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式____________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)==2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)== N2(g)+2H2O (g);△H= -534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________。
(5)已知:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-543kJ/mol
1/2H2(g)+1/2F2(g)=HF(g) △H=-269kJ/mol
H2(g)+1/2O2(g)=H2O(g) △H=-242kJ/mol
有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式:
______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰为原料制备铝鞣剂[ Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN、FeO等):
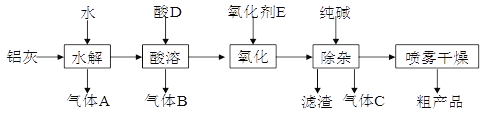
请回答下列问题:
(1)酸D的化学式为__________;气体C的电子式___________。
(2)实验室检验气体A的操作是________________;“水解”温度保持在90℃左右,写出水解生成A的化学方程式:________________________。
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是_________________;氧化剂E宜选择_________(填字母)。
A.漂白液 | B.稀硝酸 | C.酸性高锰酸钾溶液 | D.溴水 |
(4)“除杂”过程中产生滤渣的离子方程式为_________________________。
(5)粗产品略显浅黄色,可能含有的杂质主要是_________________(填化学式)。
若用“蒸发”代替“喷雾干燥”,其后果是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a在金属活动性顺序中排在氢之前,b为碳棒,下列说法中不正确的是
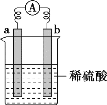
A.a极上发生还原反应,b极上发生氧化反应
B.碳棒上有气体逸出
C.导线上有电流,电子移动方向为a→b
D.反应后a极质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.32g Na2CO3、NaOH的固体混合物完全溶解于水,制成溶液,然后向该溶液中逐滴加入1 mol/L的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如下图所示,下列说法中错误的是

A. OA段发生反应的离子方程式为:H++OH-===H2O CO32-+H+===HCO3-
B. 当加入35mL盐酸时,产生CO2的体积为224mL
C. A点溶液中的溶质为NaC1、NaHCO3
D. 混合物中NaOH的质量0.60g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1H、2H、3H是三种核素,它们物理性质相同,化学性质不同
B.ZX3+的结构示意图为![]() ,该离子能促进水的电离
,该离子能促进水的电离
C.N2、H2O2、CaC2、MgCl2中都含有非极性共价键
D.由于HF分子间存在氢键,因此HF比HCl稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是
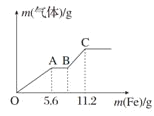
A.OA段产生的气体是NO,BC段产生的气体是H2
B.A点对应消耗NO3-物质的量为0.2 mol
C.B点对应消耗铁粉的质量为8.4 g
D.原混合酸溶液中H2SO4的浓度为4.0 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com