
【题目】铝鞣剂在皮革工业有广泛应用。某学习小组以铝灰为原料制备铝鞣剂[ Al(OH)2Cl],设计如下化工流程(提示:铝灰的主要成分是Al、Al2O3、AlN、FeO等):
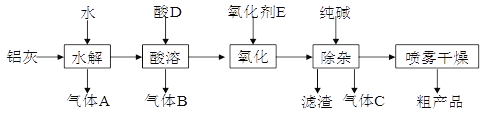
请回答下列问题:
(1)酸D的化学式为__________;气体C的电子式___________。
(2)实验室检验气体A的操作是________________;“水解”温度保持在90℃左右,写出水解生成A的化学方程式:________________________。
(3)“酸溶”温度控制在30℃~35℃,不宜太低,也不宜太高,其原因是_________________;氧化剂E宜选择_________(填字母)。
A.漂白液 | B.稀硝酸 | C.酸性高锰酸钾溶液 | D.溴水 |
(4)“除杂”过程中产生滤渣的离子方程式为_________________________。
(5)粗产品略显浅黄色,可能含有的杂质主要是_________________(填化学式)。
若用“蒸发”代替“喷雾干燥”,其后果是____________________________。
【答案】HCl ![]() 用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3(合理答案均计分)
用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3(合理答案均计分) ![]() 温度太低,反应慢;温度太高,盐酸挥发快(合理答案均计分) A 2Fe3++ 3CO32-+ 3H2O = 2Fe(OH)3↓+3CO2↑ Fe(OH)3(写任何形式的碱式氯化铁也计分) Al(OH)2Cl水解生成Al(OH)3,几乎得不到Al(OH)2Cl(或产率很低其他合理答案均计分)
温度太低,反应慢;温度太高,盐酸挥发快(合理答案均计分) A 2Fe3++ 3CO32-+ 3H2O = 2Fe(OH)3↓+3CO2↑ Fe(OH)3(写任何形式的碱式氯化铁也计分) Al(OH)2Cl水解生成Al(OH)3,几乎得不到Al(OH)2Cl(或产率很低其他合理答案均计分)
【解析】
铝灰主要成分为Al、Al2O3、AlN、FeO等,加入水发生反应,氮化铝和水反应生成氢氧化铝和氨气,即A为氨气,然后应加入盐酸溶解后,生成氯化铝溶液和氯化亚铁溶液,生成气体B为氢气,可加入漂白剂氧化亚铁离子为铁离子,加入纯碱调节溶液的pH使铁离子全部沉淀,生成气体C为二氧化碳,采用喷雾干燥制备铝鞣剂。
(1)由以上分析可知D为盐酸,气体C为二氧化碳,电子式为:![]() ;
;
(2)A为氨气,为碱性气体,可以用镊子夹取一片湿润的红色石蕊试纸接触气体A,若试纸变蓝,则A为NH3;氮化铝和水发生水解反应生成氢氧化铝和氨气,方程式为:![]() ;
;
(3)温度太低,反应慢;温度太高,盐酸挥发快,则酸溶温度控制在30℃~35℃,不宜太低或太高;漂白液的主要成分是NaClO和NaCl,其氧化Fe2+可生成Cl-,而稀硝酸、酸性高锰酸钾溶液、溴水氧化Fe2+都会有其他杂质离子生成,故只有A正确,选A;
(4)滤渣为氢氧化铁,可由铁离子与碳酸根离子水解生成,方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(5)产品含有氢氧化铁,可导致略显黄色,铝鞣剂主要成分为Al(OH)2Cl,在加热蒸发时会发生水解,为防止水解利用喷雾干燥,减少铝鞣剂水解;所以答案为:Al(OH)2Cl水解生成Al(OH)3,几乎得不到Al(OH)2Cl。


科目:高中化学 来源: 题型:
【题目】请分析下图装置。

⑴Fe电极是_____(填“正”或“负”)极,其电极反应为________;
⑵Cu电极是_____电极,其电极反应为________________。
⑶若用浓硝酸做电解质溶液____做负极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴环己烯主要用于有机合成,它可发生如图所示的转化,下列叙述错误的是( )

A. 反应①为氧化反应,产物含有溴原子和羧基两种官能团
B. 反应②为取代反应,产物含有羟基和碳碳双键两种官能团
C. 反应③为消去反应,产物含碳碳双键和溴原子两种官能团
D. 反应④为加成反应,产物只含溴原子一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水星大气中含有一种被称为硫化羰(化学式为COS)的物质。已知硫化羰与CO2的结构相似,但能在O2中完全燃烧,下列有关硫化羰的说法正确的是
A. OCS的电子式为![]()
B. OCS分子中三个原子位于同一直线上
C. OCS的沸点比CO2的低
D. OCS分子中含有1个σ键和1个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
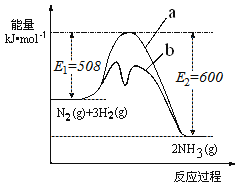
(1)根据如图提供的信息,写出该反应的热化学方程式____________________________,下图的曲线中________(填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是_____________。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n molN2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1 L的容器中加入1 mol N2、3 mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=_______________。
(4)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 |
| 1 |
ⅱ | ______ |
| 10 |
ⅲ | 480 | ______ | 10 |
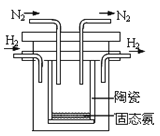
(5)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保型燃料——丙烷燃烧时发生反应的化学方程式为C3H8+5O2![]() 3CO2+4H2O。下列说法中不正确的是
3CO2+4H2O。下列说法中不正确的是
A.丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料
B.所有的燃烧反应都会释放热量
C.1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量
D.燃烧时化学能只转化为热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因是:________。
(2)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) △H=+210.5kJ· mol-1
②CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) △H=-189.2 kJ· mol-1
反应CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) △H=____kJ· mol-1
(3)在恒温条件下,1 mol NO2和足量C发生反应2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
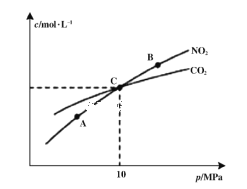
①A、B两点的浓度平衡常数关系:Kc(A) ____Kc(B)(填“<”或“>”或“=”)
②A、B、C三点中NO2的转化率最高的是____(填“A”或“B”或“C”)点。
(4)已知:亚硝酸(HNO2)性质和硝酸类似,但它是一种弱酸。常温下亚硝酸的电离平衡常数Ka=5.1×10-4;H2CO3的Ka1=4.2×10-7,Ka2=5.61×10-11。在常温下向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小的顺序是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下结构简式表示一种有机物的结构,关于其性质的叙述不正确的是( )
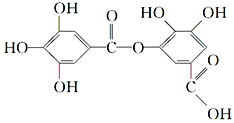
A. 它有酸性,能与纯碱溶液反应
B. 可以水解,其水解产物只有一种
C. 1mol该有机物最多能与7 mol NaOH反应
D. 该有机物能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了避免NO、NO2、N2O4对大气的污染,常采用NaOH溶液进行吸收处理(反应方程式:2NO2+2NaOH=NaNO3+NaNO2+H2O;NO2+NO+2NaOH=2NaNO2+H2O)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L NaOH溶液吸收(无气体剩余),则此NaOH溶液的物质的量浓度为( )
A.![]() mol·L-1B.
mol·L-1B.![]() mol·L-1
mol·L-1
C.![]() mol·L-1D.
mol·L-1D.![]() mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com